ВНУТРИЧЕРЕПНОЕ ДАВЛЕНИЕ И ВНУТРИЧЕРЕПНАЯ ГИПЕРТЕНЗИЯ
М.В. БАШКИРОВ, А.Р. ШАХНОВИЧ, А.Ю. ЛУБНИН. НИИ нейрохирургии им. Н.Н. Бурденко РАМН, Москва
ВВЕДЕНИЕ
Первые попытки дать научное объяснение феномену внутричерепной гипертензии (ВЧГ) предпринимались еще 200 лет назад. Но первые действительно серьезные работы, посвященные данной проблеме, появились на рубеже нашего века. К этому времени относятся работы Г. Кушинга, изучавшего эффект повышения давления ликвора при спинномозговой инъекции физиологического раствора на характеристики дыхания и кровообращения. Кушингом было отмечено, что по мере приближения величины внутричерепного давления (ВЧД) к уровню артериального давления (АД) развивалась стойкая брадикардия, повышалось АД и развивались нарушения дыхания. Этот симптомокомплекс позднее получил название триады Кушинга и считается оклассическимп признаком ВЧГ. На практике триада Кушинга наблюдается лишь у 33% больных с интракраниальной гипертензией [35]. Дальнейшим этапом в изучении проблемы ВЧД и ВЧГ стали исследования, проведенные в 20 30-е годы (Meyer, Kernohan, Moore). Было установлено, что интракраниальное содержимое неоднородно и что в норме и патологии присутствуют определенные градиенты давления между различными областями мозга, которые играют важную роль в развитии осложнений ВЧГ. Но основной этап в изучении вопроса ВЧД начался в 50 60-е годы, когда были опубликованы работы Ryder и Lundberg. Ими были разработаны и применены в клинической практике простые и безопасные методы измерения и мониторинга ВЧД, открыты основные принципы формирования и регуляции ВЧД [20].
ФИЗИОЛОГИЯ ВНУТРИЧЕРЕПНОГО ДАВЛЕНИЯ
В норме у взрослого человека в положении лежа ВЧД обычно колеблется в пределах от 3 до 15 мм рт.ст., у детей 3-7 мм рт.ст., а у новорожденных 1,5-6 мм рт.ст. При этом возможны значительные колебания ВЧД: до 50 60 мм рт.ст. при кашле, чихании или резком подъеме внутрибрюшного давления. Эти подъемы обычно непродолжительны и не приводят к нарушениям в ЦНС. Более того, при ряде патологических состояний пациенты способны в течение длительного периода времени переносить очень высокие цифры ВЧД (например, при медленнорастущих опухолях головного мозга или доброкачественной внутричерепной гипертензии) [20].
Под термином ВЧД обычно понимается некое равномерно распределенное давление в полости черепа. У взрослого человека, головной мозг и окружающие его ткани занимают определенный фиксированный объем, ограниченный ригидными костями черепа. Несколько упрощая, содержимое полости черепа можно разделить на три части: паренхима мозга, ликвор и внутрисосудистый объем крови (артериальной, венозной). На вещество мозга приходится 80 85% интракраниального объема, на ликвор и кровь 5 15% и 3 6% соответственно [24]. При наличии различных интракраниальных патологических процессов к ним может присоединяться и 4-й компонент объемное образование, в роли которого может выступать опухоль, гематома и т.д., обладающее характеристиками, отличными от нормального содержимого полости черепа (табл. 1).
Таблица 1. Компоненты интракраниального объема
| Паренхима | Кровь | Спинномозговая жидкость | Объемные образования |
| Внутриклеточная
жидкость
Цитотоксический отек |
Венозный
компонент
Венозная гипертензия |
Вентрикулярный Субарахноидальный Интерстициальный компоненты | |
| Внеклеточная
жидкость
Вазогенный отек |
Артериальный
компонент
Реактивная гиперемия Избыточная перфузия Вазопаралич |
Гидроцефалия:
Коммуникантная Обструктивная Нормотензионная Экстравентрикулярная |
Компоненты интракраниальной системы по своей природе несжимаемы, поэтому изменение объема одного из компонентов на фоне постоянного уровня ВЧД неизбежно приводит к компенсаторным изменениям величины других компонентов. Этот принцип перераспределения объемов получил название концепции Монро Келли [21].
Паренхима мозга состоит из клеточного и внеклеточного компонентов. В состав первого входят клеточные мембраны и миелин, объем которых не подвергается значительным изменениям, и собственно внутриклеточный объем, находящийся в состоянии динамического равновесия с внеклеточной жидкостью. При различных патологических процессах могут изменяться и внутриклеточный и внеклеточный компоненты (развитие цитотоксического или вазогенного отека мозга или их комбинации) 60% спинномозговой жидкости, заполняющей желудочковую систему мозга, образуется в ворсинчатых сплетениях крыши III, IV и боковых желудочков мозга. Оставшиеся 40% приходятся на трансэпендимальный перенос интерстициальной жидкости. И если ликворообразование процесс достаточно постоянный, то скорость резорбции ликвора может регулироваться в зависимости от уровня венозного давления и условий ликвородинамики. Регуляция объема интракраниальной крови осуществляется в основном за счет изменения калибра артерий и артериол мозга, давления и кровенаполнения венозных синусов. В норме величина артериального мозгового кровотока (МК) носит относительно постоянный характер при уровне систолического артериального давления в пределах 60-180 мм рт.ст. Это достигается за счет функционирования сложного гомеостатического процесса, получившего название ауторегуляции МК. Постоянство МК и, соответственно, перфузии мозга обеспечивается путем изменения калибра и сопротивления току крови сосудов мозга. На этот процесс значительное влияние оказывают также уровень парциального давления О2 и СО2. Необходимо заметить, что величина мозговой перфузии находится в прямой зависимости от величины внутричерепного давления:
CPP = MAP ICP,
где MAP среднее артериальное давление (на уровне виллизиева круга), CPP мозговое перфузионное давление, ICP уровень внутричерепного давления. В норме величина мозгового перфузионного давления выше 50 мм рт.ст. При CPP меньшем чем 50 мм рт.ст., уровень МК перестает соответствовать метаболическим потребностям мозговой ткани, развиваются гипоксия и ишемия головного мозга [4]. Известно, что при внутричерепной гипертензии происходит сужение диапазона ауторегуляции, и уровень МК по мере роста ВЧД все больше становится прямо пропорционален уровню систолического АД [11]. Особенно опасными в этой связи становятся эпизоды артериальной гипотензии, при которых происходит снижение перфузионного давления мозга ниже 50 мм рт.ст. в результате чего усугубляется уже существующая ишемия мозга, нарастает ишемический отек, что приводит к еще большему увеличению ВЧД Поэтому многие авторы рекомендуют в условиях ВЧГ, особенно после ЧМТ, поддерживать СPP на уровне не менее 70 мм рт.ст. [22; 27]. Но и чрезмерное повышение АД, приводящее к увеличению объема интракраниальной крови, также повышает уровень ВЧД и способно усугубить ВЧГ. Поэтому очень важно в этой ситуации проведение адекватного мониторинга АД, ВЧД, МК.
ПАТОФИЗИОЛОГИЯ ВНУТРИЧЕРЕПНОЙ ГИПЕРТЕНЗИИ
При повышении уровня ВЧД более 15 мм рт.ст. включаются компенсаторные механизмы, поддерживающие постоянство интракраниального объема. На первом этапе компенсация происходит за счет перемещения спинномозговой жидкости из краниального отдела в спинальный с одновременным увеличением объема резорбции ликвора (скорость продукции СМЖ остается постоянной). Изобарическая компенсация эффективна при уровне ВЧД не более 30 мм рт.ст., при дальнейшем повышении уровня ВЧД компенсация начинает осуществляться путем сокращения объема интракраниальной крови. Правда, на ранних сроках развития сначала происходит увеличение интракраниального объема крови. Компрессия мостиковых вен, соединенных с системой сагиттальных синусов, приводит к увеличению гидростатического давления в капиллярах, увеличению объема интракраниальной крови и усилению вазогенного отека мозга. Параллельно с этим падение мозгового перфузионного давления приводит к включению механизмов ауторегуляции расширению артериол и дополнительному увеличению интракраниального объема артериальной крови. Постепенно нарастают компрессия венозных сосудов и коллапс микроциркуляторного русла с последующим падением уровня МК и церебральной перфузии, нарастанием глобальной и локальной ишемии мозга. Естественно, что эти изменения носят уже чисто патологический характер. В итоге происходит прорыв ауторегуляторных механизмов, развивается состояние вазомоторного паралича, наблюдаются серьезные расстройства гемодинамики и дыхания [17; 18]. Именно на этом этапе в клинике можно наблюдать классическую триаду Кушинга: артериальную гипертензию, брадикардию и нарушения дыхания. Было замечено, что динамика изменений уровня ВЧД находится в определенной зависимости от величины объемного образования и скорости его роста. В опытах Langfitt и соавт. [19] в эпидуральное пространство вводился и последовательно раздувался воздушный баллон. Параллельно с этим производилось измерение уровня ВЧД с помощью внутрижелудочкового катетера. Первоначально при увеличении объема наблюдался лишь небольшой рост ВЧД. Но по достижении величины ВЧД в 30 мм рт.ст. малейшее увеличение объема сопровождалось резким подъемом ВЧД, а кривая зависимости давление объем приобрела экспоненциальный характер. Был сделан вывод, что такого рода скачкообразные изменения ВЧД могут соответствовать истощению компенсаторных возможностей. В то же время была сформулирована концепция мозгового комплайнса (растяжимости). Комплайнс определяется как производное отношение величины изменения объема к величине изменения давления ((V/(P) и отражает текущее состояние компенсаторных возможностей внутричерепного содержимого по поддержанию постоянного уровня ВЧД на фоне роста одного или нескольких компонентов интракраниального объема. При этом резкое падение комплайнса может служить признаком близкой декомпенсации. Возможность определить этот момент в клинической практике могла бы существенно облегчить ведение больных с внутричерепной гипертензией, в частности это касается вопроса о необходимости нейрохирургического вмешательства. Первые попытки качественной оценки уровня мозгового комплайнса проводились Miller и соавт.[26]. На фоне постоянного инвазивного мониторинга ВЧД пациентам производилась интратекальная инъекция нескольких миллилитров 0,9% раствора NaCl и фиксировались изменения величины ВЧД. Эти изменения получили название реакции объем давление (VPR) и выражались как изменение ВЧД после инъекции 1 мл 0,9% раствора NaCl в течение 1 секунды. В норме VPR составляет 2 мм рт.ст./мл, а VPR, равный или превышающий 5 мм рт.ст./мл, является признаком резкого ограничения буферных возможностей внутричерепного содержимого вне зависимости от базового уровня ВЧД. Marmarou и соавт. [24] пытались ввести еще один показатель мозгового комплайнса, так называемый индекс давление объем (VPI). PVI, представляет собой некий рассчитанный интракраниальный объем, при добавлении которого будет происходить десятикратное увеличение ВЧД. PVI равный 22 30 мл, соответствовал норме, а PVI ниже 15 мл означал критически низкий уровень мозгового комплайнса. К сожалению, оба показателя обладают довольно низкими специфичностью и чувствительностью, их определение требует сложных манипуляций с интравентрикулярными дренажами, что повышает риск развития инфекционных осложнений. Поэтому в последние годы неоднократно предпринимались попытки разработать более надежные и безопасные методы оценки комплайнса. Большие надежды возлагаются на методы качественной оценки состояния мозгового комплайнса с помощью анализа частотных характеристик волновых колебаний ВЧД. Известно, что при ВЧГ происходит не только изменение амплитуды и конфигурации волн ВЧД (рис.1), но и значительные сдвиги в спектре их базовых и гармонических частотных составляющих [33]. В работе Bray и соавт. [3] приведены результаты клинических испытаний компьютерной системы мониторинга ВЧД с одновременным анализом частотных характеристик колебаний ВЧД. Было установлено, что существует доминирующий диапазон частот (в норме 6,5 7 Гц) в спектре частот ВЧД (так называемый высокочастотный центроид high frequency centroid, HFC). При резком повышении ВЧД и, соответственно, уровня мозгового комплайнса HFC смещался в область более высоких частот 9 Гц и выше. Несмотря на довольно обнадеживающие данные первых исследований этого метода, видимо, пройдет еще немало времени до его внедрения в рутинную клиническую практику.
Рис. 1. Волны плато (Лундберга тип А) на кривой, отражающей колебания ВЧД.
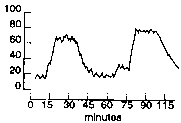
Подобного рода волны высокой амплитуды возникают при значительном повышении уровня ВЧД на фоне резкого падения сопротивления сосудов мозга и увеличения объема интракраниальной крови Как уже упоминалось, ВЧД часто рассматривается как некое равномерно распределенное давление в пределах полости черепа. Естественно, что это не совсем соответствует истине. Внутричерепное содержимое неоднородно и представляет собой комплекс иррегулярных полостей, связанных между собой. Более того, присутствие объемных образований привносит дополнительный элемент асимметрии. Намет мозжечка разделяет супра- и инфратенториальные пространства. Инфратенториальное пространство представляет собой замкнутую полость, имеющую ограниченные связи с супратенториальным пространством в районе тенториальной вырезки и со спинальным субарахноидальным пространством через foramen magnum. Супратенториальное пространство разделяется на две симметричные части относительно ригидным барьером, серпом мозга (falx cerebri). В дополнение к этому передние отделы височных долей также заключены в собственном пространстве, образованном височными костями, основной костью и наметом мозжечка. Внутри каждого из этих пространств находятся не только вещество мозга, но и кровеносные сосуды и элементы желудочковой системы. Помимо этого, на уровень комплайнса в различных отделах может влиять и вариабельное соотношение между белым и серым веществом мозга. Все этот приводит к тому, что довольно часто повышение (или понижение) ВЧД в одном из интракраниальных пространств может не отражать общего уровня ВЧД. Наиболее часто это наблюдается при обструкции путей оттока ликвора объемными образованиями. При этом формируется градиент давления между пораженной областью и остальными частями интракраниального пространства. По достижении величины градиента давления, превосходящей сопротивление мозговой ткани, происходит смещение интракраниальных структур и развивается дислокационный синдром (рис. 2). Смещение продолжается вплоть до исчезновения градиента давления или до того момента, когда физические свойства вклинившегося участка не станут ограничивать дальнейшее смещение даже при сохраняющемся градиенте давления. Например, в случае вклинения миндалин мозжечка (E на рис. 2) ВЧД и давление ликвора в спинномозговом канале будут различны. Аналогичная картина будет наблюдаться и при височном (ункальном) дислокационном синдроме (С на рис. 2). В последнем случае возможна ситуация, при которой критическое состояние больного развивается, несмотря на онормальныеп показатели ВЧД по данным мониторинга, если желудочковый катетер располагается в переднем роге бокового желудочка [24]. Поэтому особенно важно при установке и анализе результатов инвазивного мониторинга ВЧД ориентироваться на данные КТ и МРТ.
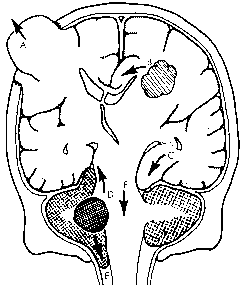
Рис. 2. Дислокационные синдромы.
А транскраниальный; B субфальксный; C транстенториальный (ункальный); D восходящий транстенториальный; E тонзиллярный; F центральный транстенториальный
Клиника внутричерепной гипертензии
Клинические проявления ВЧГ неспецифичны и развиваются вследствие растяжения или деформации чувствительных отделов кровеносных сосудов мозга и твердой мозговой оболочки. Часто при ВЧГ развивается фокальная неврологическая симптоматика, связанная с компрессионной ишемией при смещении интракраниальных структур. К числу наиболее частых симптомов при ВЧГ следует отнести диффузные головные боли, рвоту, тошноту, парез или паралич III или VI пары ЧМН. Отек зрительного нерва является более характерным для длительно персистирующей внутричерепной гипертензии. По некоторым данным [5], лишь у 3,6% пациентов на ранних сроках после тяжелой ЧМТ наблюдалось формирование отека зрительного нерва. Изменения уровня сознания, нарушения дыхания и гемодинамики развиваются при дальнейшем нарастании ВЧД. Косвенным признаком тяжелой ВЧГ является наличие объемного образования на КТ со смещением срединных структур более 0,5 см [1].
Большое число патологических состояний сопровождается повышением ВЧД (табл. 2). Наиболее часто внутричерепная гипертензия является осложнением тяжелой ЧМТ. По некоторым данным, у 54% больных после ЧМТ наблюдается клинически значимое повышение уровня ВЧД [28]. Характерно, что и во многих случаях (в среднем 50 70%) ВЧГ персистирует и после хирургической эвакуации интракраниальных гематом [23]. При этом ВЧГ является одним из важных факторов риска развития неблагоприятного исхода после ЧМТ. Например, при ВЧД, превышающем 15 мм рт.ст. неблагоприятный исход был зафиксирован у 57% пострадавших, при ВЧД менее 15 мм рт.ст. только у 23% [23].
Таблица 2. Состояния, при которых отмечается внутричерепная гипертензия
|
|
Повышение ВЧД сопровождает рост различных опухолей мозга. Влияние внутричерепной гипертензии на клиническое состояние при этом в основном определяется локализацией новообразования и скоростью его роста. Как острая, так и хроническая внутричерепная гипертензия может наблюдаться при заболеваниях самого разного профиля: гипертензивной энцефалопатии, краниостенозе, фулминантой форме вирусного гепатита и печеночной энцефалопатии, эпилептическом статусе [1; 9; 10; 31; 39; 40].
ИЗМЕРЕНИЕ И МОНИТОРИНГ ВНУТРИЧЕРЕПНОГО ДАВЛЕНИЯ
Показания и противопоказания к проведению мониторинга ВЧД
Проведение мониторинга ВЧД показано больным с нейротравмой с оценками по шкале Глазго менее 8, за исключением наличия повреждений, несовместимых с жизнью [23]. Многими авторами рекомендуется проводить мониторирование ВЧД у больных с оценкой по шкале Глазго более 8 в том случае, если удается выявить патологические изменения (участки пониженной или повышенной плотности, соответствующие отеку мозга, ушибу или гематоме, а также признаки компрессии базальных цистерн мозга) при первичном КТ-исследовании [28]. В тех случаях, если возраст больного превышает 40 лет, наблюдается децеребрационная либо декортикационная ригидность или уровень систолического АД ниже 90 мм рт.ст., возможно проведение мониторинга и при отсутствии патологических признаков на КТ [16]. Следует подчеркнуть ценность КТ-исследования для принятия решения о мониторинге ВЧД. При наличии изменений на КТ внутричерепная гипертензия диагностируется у 60% этих пациентов, при отсутствии лишь у 13% [16]. Другим распространенным показанием для проведения мониторинга ВЧД являются опухолевые заболевания ЦНС. В настоящее время мониторинг ВЧД чаще всего применяется с целью контроля уровня ВЧД во время вводного наркоза и на начальных этапах нейрохирургических операций, в раннем послеоперационном периоде у больных в коматозном состоянии органического или фармакологического генеза (барбитуратовая кома) [40]. Если применяется вентрикулостомия, то с ее помощью можно провести дренирование желудочковой системы при быстро прогрессирующей обструктивной гидроцефалии. Часто к мониторингу ВЧД приходится прибегать и в случае гидроцефалии, особенно для контроля эффективности шунтирующих операций и ранней диагностики синдрома избыточного дренирования [1]. К числу показаний для проведения длительного мониторинга ВЧД относятся многие патологические состояния, сопровождающиеся развитием внутричерепной гипертензии, когда данные неинвазивных методов диагностики не дают точной информации: инфекционные заболевания (тропическая малярия), фулминантные формы вирусного гепатита или печеночная энцефалопатия, барбитуратовая кома при некупирующемся эпилептическом статусе и др. [1; 40]. Всилу важности клинической информации, получаемой при проведении инвазивного мониторинга ВЧД, все противопоказания к его применению носят относительный характер. Представляется нецелесообразным проведение мониторинга ВЧД у больных с сохраненным уровнем сознания и клинически значимой коагулопатией (в последнем случае лучше использовать субарахноидальный болт на фоне максимально агрессивной терапии с целью нормализации свертывающей системы). Продолжительность мониторинга ВЧД диктуется клинической ситуацией, но, по мнению многих авторов, его можно прекратить через 48-72 часов после нормализации или значительного улучшения показателей ВЧД [35].
Методы измерения и мониторинга ВЧД.
За последние 30 лет было предложено и внедрено в клиническую практику большое количество различных методов измерения и мониторинга ВЧД. На современном этапе выбор того или иного способа зависит от клинической ситуации и во многом от опыта и предпочтений лечащего врача. В целом все методики могут быть подразделены на супратенториальные, инфратенториальные и люмбальные в зависимости от области измерений (табл. 3). В настоящее время наиболее часто используются супратенториальные системы мониторинга ВЧД разных типов. "Золотым стандартом" в определении величины ВЧД по сей день остается один из первых методов с применением вентрикулостомии и постановкой интравентрикулярного катетера (наружный вентрикулярный дренаж). Наиболее часто при этом гибкий пластиковый катетер вводится в передний рог бокового желудочка в непосредственной близости от отверстия Монро. Для достижения адекватного уровня измерений трансдьюсер должен быть установлен на уровне наружного слухового прохода (уровень стояния конца катетера). При правильной постановке и калибровке системы должна быть получена трехфазная кривая колебаний ВЧД. Все манипуляции с системами этого типа должны производиться с соблюдением правил асептики в связи с риском инфекционных осложнений. Несмотря на относительную безопасность и надежность, внедрение интравентрикулярных систем долгое время задерживалось. Причинами были инвазивность метода, возможность повреждения функционально важных областей мозга и кровеносных сосудов при установке катетера. Но потенциальные преимущества метода низкая стоимость, возможность дренирования ликвора или введения лекарственных препаратов (например, антибиотиков) непосредственно в желудочковую систему сделали этот метод мониторинга распространенным [38].
Таблица 3. Методы измерения и мониторинга ВЧД.
Супратенториальные:
Инфратенториальные Люмбальные |
Фиброоптические
системы
Системы с мембранными трансдьюсерами Отоакустические методы (смещение барабанной перепонки) |
Субдурально-субарахноидальные системы мониторинга ВЧД на настоящий момент являются, пожалуй, наиболее широко распространенными в клинической практике. После наложения фрезевого отверстия производится установка специального устройства оболтап, соединенного с мембранным трансдьюсером. При этом кончик болта должен выстоять в субдуральном или субарахноидальном пространстве (в зависимости от целей исследования). К преимуществам метода можно отнести легкость установки и низкую вероятность травматизации подлежащих тканей мозга. Как и в случае с интравентрикулярными устройствами, субарахноидальные системы подвержены обструкции (ткань мозга, сгустки крови после субарахноидальных кровоизлияний). При этом резко падает точность измерений чаще всего в сторону занижения реально существующего уровня ВЧД. В последние годы появился ряд сообщений о применении интравентрикулярных систем мониторинга ВЧД с фиброоптическими датчиками, не требующими повторной калибровки после каждого изменения положения тела пациента [14].
Более современным методом мониторинга уровня ВЧД являются системы с применением инвазивных интрапаренхиматозных датчиков. Наиболее распространенная модель Camino состоит из тонкого фиброптического провода, соединенного с миниатюрным трансдьюсером на конце (рис. 3). Подобные системы отличаются легкостью установки и низкой травматизацией мозга. Дополнительными преимуществами этого метода являются возможность мониторинга ВЧД в условиях значительного отека мозга и компрессии желудочков, легкость в обращении (калибровка и установка на онольп проводится однократно) и относительная безопасность этого метода [7]. Несмотря на это, необходимо помнить, что практически все модели интрапаренхиматозных мониторов уровня ВЧД достаточно хрупки и подвержены определенному дрейфу при измерениях, что может приводить к искажению значений ВЧД [6; 7; 37]. В ряде исследований сообщается о необходимости замены фиброптических систем в связи с чрезмерным искажением реального уровня ВЧД или другими механическими проблемами вплоть до 38% случаев [37].
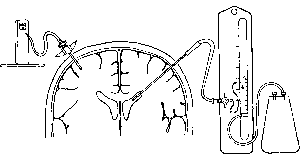
Рис. 3. Вентрикулярные и интрапаренхиматозные системы мониторинга уровня ВЧД.
Входной клапан в вентрикулярной системе (справа) должен быть установлен на одном уровне с концом внутрижелудочкового катетера для правильной калибровки системы. При этом высота столбика СМЖ в мерном цилиндре соответствует величине ВЧД. При установке интрапаренхиматозной мониторинговой системы (слева) калибровка на онольп должна производиться до постановки катетера.
До последнего времени мониторинг ВЧД в области задней черепной ямки не пользовался популярностью в связи с трудностями при установке катетеров или болта. Не получила распространения и интраоперационная установка систем для измерения ВЧД по большей части в связи с риском возможных осложнений, к примеру формированием псевдоменингоцеле. С другой стороны, в недавно опубликованной работе Rosenwasser и соавт. [34] сообщается об успешном применении фиброптической системы мониторинга ВЧД в области задней черепной ямки в послеоперационном периоде. Более того, была установлена статистически достоверная разница между уровнями ВЧД на супратенториальном и инфратенториальном уровне, пренебрежение которой при рутинных методах мониторинга ВЧД способно, по мнению авторов, влиять на результаты лечения. Ранние попытки оценить величину ВЧД путем измерения давления СМЖ были неуспешны и более того нередко приводили к ухудшению состояния больных. В наше время постоянные люмбальные катетеры используются в основном для дренажа СМЖ в послеоперационном периоде с целью профилактики ликвореи или с целью релаксации мозга во время нейрохирургических вмешательств. В то же время в некоторых клинических ситуациях, при которых риск развития вклинения невысок (менингит, коммуникантная форма гидроцефалии, доброкачественная внутричерепная гипертензия), измерение уровня давления СМЖ может использоваться для косвенного определения значения ВЧД.
В последнее время появилось несколько сообщений о возможности проведения неинвазивного мониторинга ВЧД с помощью так называемого теста на смещение барабанной перепонки [36]. Как известно, при изменении уровня внутричерепного давления происходит и изменение уровня давления перилимфы в лабиринте улитки, что, в свою очередь, приводит к смещению (деформации) барабанной перепонки. Наиболее достоверные данные были получены в группе больных молодого возраста с гидроцефалией или доброкачественной внутричерепной гипертензией. Обязательным условием применения этой методики является сохранность структур среднего уха и ствола мозга [32]. Данная методика позволяет проводить неинвазивный мониторинг ВЧД у больных с гидроцефалией после шунтирующей операции [36].
Осложнения и проблемы при проведении мониторинга ВЧД
Использование мониторинга ВЧД может сопровождаться различными осложнениями (табл. 4). К числу наиболее частых относятся инфекционные осложнения. При этом наибольшая частота инфекционных осложнений наблюдалась при применении интравентрикулярных (в среднем 10 17%) и интрапаренхиматозных систем (в среднем 12 17%) [2; 12; 13; 25; 30]. В отличие от них при использовании субдуральных и субарахноидальных систем эти показатели были существенно ниже (5 и 4% соответственно) [15; 35]. Необходимо заметить, что частота серьезных инфекционных осложнений (вентрикулит) была крайне низка, и во многих работах в число инфекционных осложнений включалось и наличие бактериальной контаминации [25; 37]. Среди факторов, предрасполагающих к развитию инфекционных осложнений при проведении мониторинга ВЧД, относятся: уровень ВЧД более 20 мм рт.ст., наличие внутричерепного кровоизлияния с проникновением крови в желудочки, сопутствующие инфекции, нейрохирургическое вмешательство, продолжительность инвазивного мониторинга более 5 дней. Значение последнего фактора, правда, подвергается сомнению. Так, по данным Hollaway и соавт. [12], длительность мониторинга не оказывала существенного влияния на частоту инфекционных осложнений. Авторам также представляются необоснованными рекомендации о необходимости замены инвазивных датчиков каждые 5 дней. Главным, по их мнению, фактором риска для развития инфекционных осложнений в ходе мониторинга ВЧД является несоблюдение правил асептики при первичной установке системы. При подозрении или подтверждении развития инфекционного процесса, связанного с проведением инвазивного мониторинга ВЧД, необходимо удалить всю систему и назначить курс антибиотикотерапии.
Другим осложнением инвазивного мониторинга ВЧД являются внутримозговые кровоизлияния. Средняя частота этого осложнения оставляет 1,4% для всех способов мониторинга, но только в 0,5% случаев была необходима эвакуация гематомы [30].
Одной из наиболее распространенных проблем, возникающих при эксплуатации систем инвазивного мониторинга ВЧД, является обструкция интракраниальных частей системы (до 16% в случае субдуральной локализации катетера) [37; 38].
ЗАКЛЮЧЕНИЕ
Понимание основ регуляции ВЧД в норме и при различных патологических состояниях, владение и способность адекватно интерпретировать данные инвазивного мониторинга ВЧД в сочетании с результатами клинических, лабораторных и рентгенологических методов исследования безусловно могут оказать существенную помощь врачу в лечении больных с внутричерепной гипертензией.
ЛИТЕРАТУРА
- Allen R. Intracranial pressure: a review of clinical problems, measurement techniques and monitoring methods.// J. Med. Eng. Technol.1986. V.10 p. 299-320.
- Aucoin P.J., Kottilainen H.R., Gantz N.M. et al. Intracranial pressure monitors. Epidemiologic study of risk factors and infections.// Am. J. Med. 1986. V.80 p.369-376.
- Bray R.S., Sherwool A.M., Halter J.A. et al. Development of clinical monitoring system by means of ICP waveform analysis.// In: Miller J.D.,
- Teasdale G.M., Rowan J.O. et al, (eds): Intracranial pressure. VI. Berlin, 1986, Spinger-Verlag, p. 260-264.
- Bouma C.G., Mouzelaar T.R. Relationship between cardiac output and CBF in patients with intact and impaired autoregulation.// J. Neurosurg. 1990. V.73 p.368-74.
- Bullock R, Chestnut P.M., Clifton E. Guidelines for the management of severe head injury. The Brain Trauma Foundation, NY, The American Association OF Neurosurgeons, IL and The Joint Section of Neurotrauma and Critical Care, 1995.
- Chambers I.R., Mendelow A.D., Sinar E.J. A clinical evaluation of the Camino subdural screw and ventricular monitoring kits.// Neurosurgery. 1990. V.26 p.421-423.
- Czosnyka M, Czonyka Z, Pickard J.D. Laboratory testing of three intracranial pressure microtransducers: technical report. //Neurosurgery. 1996. V.38 p.219-224.
- Crutchfield J.S., Narayan R.K., Robertson C.S. Evaluation of a fiberoptic intracranial pressure monitor.// J. Neurosurg. 1990. V. 72 p.482-87.
- Ggriswold W.R., Viney J., Mendoza S.A., James H.E. Intracranial pressure monitoring in severe hypertensive encephalopathy.// Crit Care Med. 1981.V.9 p.573-576.
- Haller J. Intracranial pressure monitoring in Reye's syndrome.// Hosp. Pract. 1980.V.15 p. 101-108
- Hauerberg J., Xiaodogn M., Willumsen L. et al. The upper limit of cerebral autoregulation of cerebral blood flow autoregulation in acute intracranial hypertension.// J. Neurosurg. Anesthesiol. 1998. V.10 p.106-112.
- Holloway K.L., Barnes T., Choi S. Ventriculostomy infections: The effect of monitoring duration and exchange in 584 patients.// J Neurosurg. 1996.V.85 p.419-24.
- Jensen R.L., Hahn Y.S., Ciro E. Risk factors of intracranial pressure monitoring in children with fiberoptic devices: a critical review.// Surg. Neurol. 1997.V.47 p.16-22. Kasai K., Samejima H., Ueda M., Ushikubo Y. et al. Intracranial pressure monitoring using a newly developed transducer-tipped ventricular drainage catheter.// Neurol. Med. Chir. (Tokyo).1998. V.38 p.238-240.
- Kaufmann G.E., Clark K. Continuous-simultaneous monitoring of the ventricular and cervical subarachnoidal cerebrospinal fluid pressures to indicate development of cerebral or tonsillar herniation.// J. Neurosurg. 1970.V.33 p.145-150.
- Kishore P.R., Lipper M.H., Becker D.P. Narayan R.K. et al. Significance of CT in head injury: correlation with intracranial pressure.// Am. J. Roentgenol. 1981.V.137 p.829-833.
- Kjallquist A., Lunberg N., Ponten U. Respiratory and cardiovascular changes during spontaneous variations of ventricular fluid pressure in patients with intracranial hypertension.// Aacta Neurol. Scand. 1964.V.40 p.291-317.
- Langfitt T.W., Winn H.R., Kassel et al. Cerebral vasomotor paralysis produced by intracranial hypertension.// Neurology.1965. V.15 p.622-641.
- Langfitt T.W., Weinstein J.D., Kassell N.F.. Transmission of increased intracranial pressure. I. Within the craniospinal axis.// J. Neurosurg. 1964. V.21 p.989-997. Lundberg N. Continuous recording and monitoring of ventricular fluid pressure in neurosurgical practice.// Acta Psychiatr. Neurol. Scand. 1960. V. 36 (Suppl 149) p.17-25.
- Lundberg N. The sage of the Monroe-Kellie doctrine.// In IschiiH, NagaiH, Brock M, (eds): Intracranial pressure V, Berlin, 1983, Springer-Verlag. p.29-34.
- Marmarou A., Anderson R.L., Ward J.D.. Impact of ICP instability and hypotension on outcome in patients with severe head injury.// J. Neurosurg. 1991. V.75 (Suppl) p.S59-S66.
- Marmarou A., Anderson R.L. Ward et al. NINDS traumatic coma data bank: intracranial pressure monitoring methodology.// J. Neurosurg. 1991. V. 75 (Suppl) p.S21-S27.
- Marmarou A., Shulman K., La Morgese J. Compartmental analysis of compliance and outflow resistance of the cerebrospinal fluid system.// J. Neurosurg.1976.V.43 p.523-534.
- Mayhall C.G., Labm V.A., Arsler N. Ventriculostomy-related infections: A prospective epidemiological study.// New Engl. J. Med. 1989. V.310 p.553-9.
- Miller J.D., Pickard J.D. Intracranial volume-pressure studies in patients with head injury. //Injury. 1974. V.5 p.265-269.
- Muizelaar J.P., Marmarou A., De Salles AAF. Cerebral blood flow and metabolism in severely head injured children. I. Relationship with GCS score, ICP, outcome and PVI.// J. Neurosurg. 1991.V.75 p.731-739.
- Narayan R.K., Kishore P.R.S., Becker P.P. et al. Intracranial hypertension: To monitor or not to monitor. A review of our experience with severe head injury.// J. Neurosurg.1982.V.56 p.650-59.
- Ostrup Rc., Luerssen T.G., Marshall L.E. et al. Continuous monitoring of intracranial pressure with a miniaturized fiberoptic device.// J. Neurosrg. 1987. V.67 p.206-209.
- Paramore C.G., Turner P.A. Relative risks of ventriculostomy infections and morbidity. //Acta Neurochir. 1994.V.127 p.79-84.
- Radhakristan K., Ashskog J.E., Garrity J. Idiopathic intracranial hypertension.// Mayo Clin Proc. 1994.V.69 p.169-180.
- Reid A., Marchbanks R.J., Bateman D.E. et al. Mean intracranial pressure monitoring by non-invasive audiological technique: a pilot study.// J. Neurol.
- Neurosurg. Psychiatry. 1989. V.52 p.610-612.
- Robertson C.S., Narayan R.K., Contant C.F. et al. Clinical experience with a continuous monitor of intracranial compliance.// J. Neurosurg.1989.V.71 p. 673-680.
- Rosenwasser R.H., Kleiner L.I., Krzemonski J.P. et al. Intracranial pressure monitoring in the posterior fossa. A preliminary report.// J. Neurosurg. 1989. V.71 p.503-505.
- Rosner M.J., Becker D.P. ICP monitoring: complications and associated factors.// Clin Neurosurg. 1976.V.23 p.494-519.
- Samuel M., Burge D.M., Marchbanks R.J. Tympanic membrane displacement testing in regular assessment of intracranial pressure in eight children with shunted hydrocephalus.// J. Neurosurg. 1998. V.88 p.983-995.
- Shapiro S., Bowman R., Calahan J. et al. The fiberoptic intraparenchymal cerebral pressure monitor in 244 patients.// Surg. Neurol.1996. V.45 p.278-282.
- Smith R.N., Alksien I.F. Infectious Complications of the use of external ventriculostomy. // J. Neurosurg. 1976. V.44 p.567-70.
- Whittle I.R., Besser M., Johnston I.H. Intracranial pressure in craniostenosis.// Surg. Neurol. 1984. V.21 p.367-372.
- Young W.L., Mc Cormick P.C. Perioperative management of intracranial catastrophes.// Crit. Care Clin. 1989. V.5 p.821-844.