© КОЛЛЕКТИВ АВТОРОВ, 2000
УДК 616.133.33/.
145.11-089.1661-07:616.152.21
А. В. Шмигельский, А. Ю. Лубнин, В. И.
Лукьянов
ЦЕРЕБРАЛЬНАЯ ОКСИМЕТРИЯ У
НЕЙРОХИРУРГИЧЕСКИХ БОЛЬНЫХ С СОСУДИСТОЙ
ПАТОЛОГИЕЙ
ГОЛОВНОГО МОЗГА
Часть
I. Анализ причин
интраоперационной динамики показателя rSO2
и ее прогностическое значение
НИИ нейрохирургии им. Н. Н. Бурденко,
РАМН, Москва
CEREBRAL OXYMETRY IN NEUROSURGICAL PATIENTS WITH
CEREBROVASCULAR DISEASE. PART I. ANALYSIS OF CAUSES OF INTRAOPERATIVE CHANGES
IN rSO2 VALUE AND ITS PROGNOSTIC SIGNIFICANCE
A. V. Shmigelsky, A. Yu. Lubnin, О. В. Sazonova
A total of 144
neurosurgical interventions were performed in 138 patients with
cerebrovascular diseases (arterial aneu-rysms in the acute
and cold periods after a subarachnoidal hemorrhage, arteriovenous
malformations, and carotid-cavernous anastomoses). Intraoperative monitoring
of regional saturation of hemoglobin with oxygen in the blood flowing in brain vessels was carried out by a cerebral oxymeter
INVOS 3100 for early intraoperative diagnosis of cerebral ischemia. This paper analyzes factors affecting changes in rSO2 parameter
during surgery and discusses the prognostic significance of the detected
shifts. Various factors affected the time course ofrS02: decrease in AP within
the framework of controlled arterial hypotone and other causes, insertion of
autosupported retractor spatulae, temporary clipping and embolism of cerebral arteries, vasospasm, aneurysm rupture, dissection of
arteriovenous malformation, etc. Any intraoperative shift ofrSO2 surpassing 5%, no matter of what direction (decrease
or increase), deserves special attention of anesthesiologist, as it
indicates development of cerebral ischemia with a high degree of probability.
Оперативные
вмешательства у нейрохирургических больных с сосудистой патологией
головного мозга связаны с высоким риском
развития церебральной ишемии (ЦИ), что
обусловлено сочетанием ряда провоцирующих факторов [3, 4, И, 12,
18, 25—28].
ЦИ является ведущим осложнением и именно она формирует
относительно высокую летальность
и инвалидизацию в этой группе больных.
К сожалению, несмотря на
существенные достижения
в экспериментальной фармакологической терапии ЦИ, клинически
достоверно проверенных методов
ее лечения в настоящее время практически нет,
а для инициации ишемического процесса в мозге
(в условиях нормотермии и при отсутствии фармакологической защиты) достаточно
всего лишь 5—7 мин
[3, 14, 20]. Все сказанное выше обусловливает
исключительную важность ранней интраоперационной
диагностики ЦИ. Именно ранняя
диагностика развивающегося осложнения
позволяет вмешаться в процесс до того
момента, когда ишемическое поражение
приобретает необратимый
характер.
За
последние годы в различных лабораториях мира были созданы коммерчески
доступные приборы
— церебральные оксиметры, работающие по
принципу инфракрасной спектроскопии
отраженного
света определенной длины волны, позволяющие оценивать в реальном
масштабе времени и с минимальной
задержкой степень насыщения гемоглобина кислородом в
крови, протекающей по церебральным
сосудам [8, 17, 21—24, 29]. Следует подчеркнуть,
что именно увеличение экстракции кислорода
из протекающей крови и как результат падения насыщения гемоглобина
кислородом в ней и является одним из первых
признаков развивающейся тканевой
гипоксии и ишемии.
Практически
полное отсутствие в литературе данных по использованию
церебральных оксиметров
в целях ранней интраоперационной
диагностики ЦИ у нейрохирургических
больных, оперируемых
на сосудах мозга, и побудило нас провести
настоящее исследование.
Материал
и методы. Интраоперационный
мониторинг церебральной оксиметрии (ЦО) был проведен
в 144 исследованиях
у 138 больных с различной патологией
сосудов головного мозга. Приемлемые для
анализа кривые были получены в 123 наблюдениях. Группу, подвергнутую
анализу, составили больные
в возрасте от 17 до 65 лет (средний возраст
составил 37,4 + 13,4 года).
Характеристика больных по основной нейрохирургической патологии была
следующей: артериальные аневризмы
сосудов виллизиева круга — 100 (81,3%), артерио-венозные
мальформации (АВМ) — 19 (15,4%), каротидно-кавернозные
соустья (ККС) — 4 (3,3%). 70 больных с артериальными аневризмами передних отделов
виллизиева круга были оперированы
в холодном периоде перенесенного
субарахноидального
кровоизлияния — САК. Их состояние до
операции оценивали
как относительно удовлетворительное. 30
больных были оперированы в остром и подостром
периодах САК (до 14
дней после перенесенного кровоизлияния).
Их состояние оценивали
как средней тяжести или тяжелое (2—4 класс
по классификации
Ханта и Хесса).
В
нашем исследовании мы использовали
церебральный оксиметр INVOS-3100
фирмы "Somanetics Corp."
(США), принцип
работы которого и основные характеристики
были рассмотрены нами ранее [8]. В ходе
мониторинга ЦО получали кривую
rSO2 (регионарного насыщения
гемоглобина кислородом). Динамику
показателя сопоставляли с процессами,
совпадающими
с ней по времени (например, начало и
окончание снижения АД в рамках
управляемой артериальной гипотонии (УАГ),
наложение и снятие временного зажима на
сосуд, установка
шпателей ретрактора и т. д.). Значительным
считали изменения показателя 5% и более
абсолютной величины (предел ошибки метода).
Найденную
в ходе интраоперационного мониторинга rSO2
сопоставляли
с послеоперационной очаговой или
общемозговой симптоматикой, а
также результатами специальных исследований (ЭЭГ, КТ) для выявления
клинически "немых" ишемических
очагов.
Все
числовые результаты были обработаны с
помощью методов вариационной
статистики.
Результаты
исследований и их обсуждение.
I.
Анализ факторов, влияющих на
интраоперационную динамику показателя rSO2
Когда
мы начинали работу, то исследований подобного рода у
нейрохирургических больных с сосудистой
патологией головного мозга не было (впрочем, и сейчас их единицы).
Поэтому воспользовавшись
ясностью интраоперационной ситуации,
когда относительно легко сопоставить
какой-либо
процесс с динамикой rSO2,
мы попытались оценить
направленность динамики и причины, приводящие к сдвигам rSO2 во время операции.
Распределение
обследованных4 больных по направленности
интраоперационной динамики показателя
представлено в табл. 1. Как видно из приводимых в этой таблице
данных, для большинства обследованных больных было характерно
наличие интраоперационной
динамики показателя той или иной направленности. При этом
ишемические осложнения в
послеоперационном периоде возникли во всех группах.
Далее
мы попытались определить все возможные факторы, влияющие на
динамику rSO2: результаты этого анализа приведены в табл. 2.
УАГ
ранее очень широко использовали в хирургии церебральных аневризм, и в
настоящее время ее
продолжают использовать у больных,
оперированных в холодном периоде САК, у
которых ауторегуляция
мозгового кровотока сохранена [1, 13, 15, 16, 19]. Основной отрицательный эффект
УАГ связан с риском развития ЦИ, точно
предсказать который достаточно сложно [9,
10, 15, 19]. На рис. 1, а приведен характерный
пример динамики rS02
на фоне УАГ и несколько ранее 2-кратного
временного клипирования (ВК) несущего
сосуда. Видна характерная динамика
показателя, свидетельствующая об
определенной степени ишемии.

Снижение
АД, обусловленное не УАГ, также способно
привести к изменению значений rSO2. На рис.
1, б приведен пример динамики rSO2 у больной на
фоне постуральной гипотензии (перевод
больного в положение сидя) и операционной
кровопо-тери.
В
отличие от метода УАГ, при котором существует
риск глобальной ишемии головного мозга,
при ВК присутствует риск регионарной ишемии
[14, 20, 28]. Диагностировать развитие
регионарной
ишемии в период
временного выключения крово-тока
по несущей аневризму артерии с помощью церебрального оксиметра
достаточно сложно из-за трудностей
корректного размещения сенсора, так как зона регионарной ишемии
чаще всего совпадает
с областью операционной раны. Однако в
ряде клинических наблюдений
нам это удалось. Пример кривой
динамики rSO2
при ВК приведен на рис. 2, а.
Эмболические
осложнения развиваются достаточно
часто во время эндоваскулярных вмешательств.
Во всех наблюдениях эмболии церебральных
артерий отмечали немедленное острое снижение
значений rSO2. Пример кривой динамики rSO2
при
возникновении ЦИ в результате эмболии
средней мозговой артерии
оторвавшимся баллоном приведен
на рис. 2, б.


Ранее
и экспериментально, и клинически было
показано, что шпатели самоудерживающихся
ретракторов в состоянии
вызывать ишемическое повреждение в отделах мозга,
подвергаемых тракции [6,
7, 30]. В наших наблюдениях мы достаточно часто
сталкивались со снижением rSO2, которое четко совпадало по
времени с моментом установки шпателей
ретрактора. Пример динамики rSO2
в результате
давления на мозг шпателей
самоудерживающихся ретракторов приведен
на рис. 3.

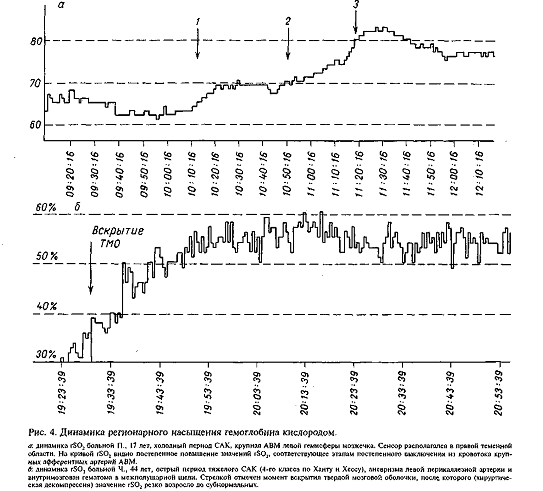
На
рис. 4, а динамика показателя rSO2
была характерна для большинства больных
с АВМ и вполне объяснима с позиций
современной концепции патофизиологии
мозгового кровотока (МК). С помощью различных методов
изучения церебрального
кровотока и метаболизма, включая такие
сложные, как позитронная эмиссионная
томография (ПЭТ), было
показано, что даже при относительно небольших
полушарных АВМ за счет шунтирования
крови по сосудам мальформации
формируется распространенный феномен обкрадывания,
который охватывает не только
перифокальную зону АВМ, но и противоположное полушарие.
Естественно,
что устранение шунта при выключении АВМ повышает значения МК до
нормальных, а иногда и до сверхнормальных значений
(синдром гиперперфузии)
во всех отделах мозга, приводя к повышению
доставки О2 и как следствие к повышению
значений rSO2.
Еще
на заре клинического применения церебральной оксиметрии у больных в
остром периоде аневризматического
САК была описана характерная динамика значений rSO2
в виде выраженных колебаний
показателя [21—24]. В условиях недавно перенесенного САК любые
манипуляции хирурга
Известно,
что величина внутричерепного давления (ВЧД)
в условиях герметичной полости черепа
может оказывать существенное влияние на
величину МК [2]. В условиях
интракраниальной нейрохирургической
операции, когда герметичность черепа нарушена, ВЧД близко к
атмосферному и не влияет
на МК. Нарастание значений rSO2,
в нижеприведенном
примере у больной с выраженной внутричерепной
гипертензией, было связано с хирургической
декомпрессией, произошедшей после вскрытия твердой мозговой оболочки и
удаления гематомы (рис.
4, б).
на сосудах могут
провоцировать развитие вазоспазма или усугублять его выраженность. В
отдельных наблюдениях
выраженные колебания значений rSO2
удавалось купировать введением
папаверина. У 48 (39%) наших больных из 123
мы также отметили наличие подобной
динамики rSO2
различной степени
выраженности (рис. 5, а).

У
всех больных, оперированных эндоваскулярным методом, в процессе операии
неоднократно интраартериально
вводили рентгеноконтрастный препарат, что немедленно
вызывало пиковое повышение
значений rSO2. При этом временная связь прослеживалась очень
четко: сразу же после интраартериального
введения контраста с последующим быстрым восстановлением
прежних значений rSO2 (см. рис. 5, б). Молекула
рентгеноконтрастного вещества
не является хромофором в отличие от молекулы
гемоглобина, но, повидимому, может изменять
физикооптические свойства среды и степень поглощения
инфракрасного спектра светового
пучка, используемого в данном методе, в
момент прохождения контраста по сосудам.
Нам представляется, что такая реакция
прибора на селективное (только
в сосуды системы внутренней сонной артерии) введение контраста без
попадания его в систему
наружной сонной артерии может служить дополнительным
подтверждением того, что сенсор прибора
оценивает состояние именно головного мозга, а не кожных покровов, как
считают некоторые
исследователи.
На
рис. 6, а приведен пример,
свидетельствующий, что ЦО может являться
диагностическим методом
выявления сосудистой катастрофы, произошедшей на ранних этапах
операции. Разрыв и кровотечение
из невыделенной аневризмы на этапах интубации трахеи или
трепанации является относительно редким,
но крайне тяжелым осложнением
[5]. Наиболее часто причиной этого
осложнения являются ошибки в
проведении анестезиологического
обеспечения, приводящие к острому повышению системного АД. Реже разрыв
происходит спонтанно
на фоне стабильной гемодинамики (см. рис. 6, б), как это было в
нашем клиническом наблюдении,
что вызывало острое обвальное снижение значений rSO2.

Анализ
нашего клинического материала позволил выделить группу факторов,
приводящих к выраженной
динамике монитерируемого показателя регионарной церебральной
сатурации. Частота встречаемости
каждого из факторов различна: от единичных наблюдений (интраоперационный
разрыв
аневризмы) до закономерно наблюдаемых практически при каждой
операции феноменов (шпатели
ретрактора, временное клипирование, УАГ). Значение каждого из
установленных факторов как для больного,
так и для выбора тактики его лечения, различно.
Вместе с тем в связи с практически
полным отсутствием опыта клинического применения
ЦО у нейрохирургических больных, полученные
данные нам представляются весьма важными.
Церебральный оксиметр дает лишь информацию
о значениях и динамике показателя rSO2 и задача клинициста по
возможности быстро и безошибочно
трактовать полученную информацию. Возможно, в этом
аспекте полученные нами данные
могут оказаться полезными.
II.
Анализ прогностической значимости
интраоперационной динамики rSO2
Как
было показано выше, у больных, оперированных по поводу сосудистой
патологии головного мозга,
по разным причинам на разное время и на разную величину показатель rSO2 уменьшался во время интраоперационного
периода. Наибольший интерес с
рассматриваемых позиций имеет анализ наблюдений, в которых
интраоперационная динамика
значений rSO2 сопровождалась развитием очаговой или
общемозговой неврологической симптоматики
в раннем послеоперационном периоде, т. е.
анализ прогностической значимости динамики
rSO2. Таких наблюдений
оказалось 36 (29,2%). Распределение
больных с осложненным течением в раннем послеоперационном
периоде в зависимости
от характера интраоперационной динамики rSO2
приведено в табл. 3 и на рис. 7.
В
случае снижения значений rSO2
во время операции
отрицательная неврологическая динамика возникла у 26 больных, из них у 14
(53,8%) снижение мониторируемого
показателя rSO2
сохранялось и значения
регионарной сатурации в конце операции оставались сниженными более
чем на 5% от исходных
величин. Из 74 больных, у которых произошло
снижение rSO2, мониторируемый показатель не вернулся к исходным
значениям у 24, что составляет 32,4%. Это явление заслуживает особого
внимания. Снижение значений rSO2 говорит о возникновении
ЦИ,
однако не указывает на ее глубину и не определяет обратимости повреждений.
Кроме того, процессы
восстановления имеют свои временные характеристики. Как нам
представляется, в наблюдениях,
когда не происходит восстановления
значений регионарного насыщения
гемоглобина кислородом до
исходных величин, следует думать о
возникновении глубоких
ишемических изменений в контролируемой
области головного мозга (вплоть до необратимых
повреждений), которые требуют для своей

компенсации большего
времени, чем
продолжительность операционного
периода.
Статистический
анализ динамики значений мониторируемого показателя
показал, что средние отклонения
(повышение или снижение) мониторируемого
показателя у больных, имеющих отрицательную неврологическую динамику,
равны 17,0 ± 9,7%, и практически не отличаются
от значений в
группе, не имеющей осложнений в ближайшем
послеоперационном периоде — 18,0 ± 10,4%. Однако
при этом нами была выявлена достоверная корреляция
(р < 0,02) между динамикой отклонений
rSO2 более чем на 5% от
исходных значений в ходе
операции и появлением отрицательной неврологической
симптоматики в послеоперационном периоде. Это доказывает, что уже наличие
динамики значений
rSO2 любой направленности, а
не ее величина и направленность говорит о
возникновении регионарной ишемии
головного мозга. По нашим данным,
в группе наблюдений "с динамикой
значений rSO2" вероятность появлений стойкого
ишемического фокуса в головном мозге,
проявляющегося нарастанием неврологической
симптоматики в послеоперационном
периоде, достигает 60%. Предиктивность метода ЦО в отношении
ишемических нарушений
во время операций на сосудах головного мозга, равная 60%, достаточно высока.
Однако нам представляется,
что истинная чувствительность метода
в отношении ЦИ является еще более высокой. Это
основывается на двух моментах: первых — это
доказанный в настоящее время факт
возможности существования так называемых "немых
очагов", которые, несмотря на
наличие характерной картины на КТ и МРТ, не
дают никакой неврологической симптоматики.
Вполне возможно, что в нашей серии
больных с интраоперационной динамикой rSO2
также
встречались такие больные. Для получения
ответа на этот вопрос мы провели
сопоставление данных
контрольных КТ с послеоперационной
неврологической симптоматикой.
Полученные результаты
этого сопоставления подтвердили правильность нашего предположения. Второй
момент — это возможность того, что
динамика rSO2 действительно отражает развитие
определенной степени ишемизации
головного мозга, но уровень этой ишемии является функционально обратимым
и поэтому формирования
ишемического очага и соответственно появления
неврологической симптоматики в послеоперационном
периоде не происходит. Для проверки
этого предположения, которое может
изменить наше
представление о чувствительности метода
ЦО, мы провели
параллельный мониторинг ЦО и ЭЭГ/ ЭКоГ во время операции. Об этом будет
сказано во второй
части нашей статьи. Следующий важный момент,
на который мы хотели бы обратить внимание,
— это существенное опережение динамики значений
rSO2 возникновения
неврологической симптоматики
у больных с развивающимся очагом ишемии;
это наглядно демонстрирует клинический
пример, приведенный на рис. 2, б.
В
данном наблюдении больной был оперирован в сознании и доступен
динамическому неврологическому
контролю. В условиях комбинированного эндотрахеального наркоза
неврологическая симптоматика
могла бы быть выявлена только после пробуждения
больного, а это упущенное время для
проведения экстренных терапевтических и
хирургических манипуляций.
Следовательно,
анализ полученных данных позволяет с уверенностью
высказаться о высокой прогностической
значимости метода ЦО в интраоперационной диагностике ЦИ у
нейрохирургических больных,
оперируемых на сосудах головного мозга. Клиницист, используя
мониторинг церебральной оксигенации с
помощью церебрального оксиметра, должен
представлять, что любая динамика мониторируемого
показателя в ходе операции с высокой степенью
вероятности свидетельствует о развитии ЦИ.
И если в послеоперационном периоде у больного,
несмотря на наличие интраоперационной динамики
rSO2, не отмечается нарастания неврологической симптоматики, то
это еще не свидетельствует о
том, что больной не перенес определенную
степень ЦИ. Временные же характеристики
реакции ЦО на ишемию
таковы, что она опережает развитие
неврологической симптоматики на 5—10 мин.
ВЫВОДЫ
1.
В ходе нейрохирургических вмешательств на
церебральных сосудах
присутствуют факторы, способные
влиять на динамику rSO2.
К важнейшим из них
относятся управляемая артериальная
гипотония, временное клипирование
несущего сосуда, эффект шпателей самоудерживающегося
ретрактора, эмболия,
системные нарушения гемодинамики, артериовенозное
шунтирование, внутричерепная гипертензия,
усугубление вазоспазма, интраоперационныи
разрыв аневризмы. Клиническое значение
данных факторов не одинаково, и их следует учитывать
при трактовке динамики rSO2.
2.
В прогностическом отношении наличие интраоперационной
динамики показателей rSO2, как в сторону снижения, так и
в сторону увеличения на величину
более 5% от исходных значений, связано с 60% вероятностью развития
необратимого ишемического повреждения
головного мозга, диагностируемого
в раннем послеоперационном периоде.
ЛИТЕРАТУРА
1.
Баранов О. А., Лубнин А. Ю. // Актуальные
вопросы неврологии, психиатрии и
нейрохирургии. — Рига, 1985. -Т.
3. - С. 90-93.
2.
Башкиров М. В., Шахнович А. Р., Лубнин А. Ю. // Рос.
журн. анест. интенсив,
тер, — 1999. — № 1, — С. 4—12.
3.
Крылов В. В., Лебедев В. В., Захаров А. И. и
др. // Журн. Вопр.
нейрохир. — 1997. — № 1. — С. 7—11.
4.
Хирургия аневризм головного мозга в остром
периоде кровоизлияния / Лебедев В. В., Крылов
В. В., Холодов С. А. и др. - М., 1996.
5.
Лубнин А. Ю., Шишкина Л. В., Филатов Ю. М.,
Салалыкин В. И. II
Журн. Вопр. нейрохир. - 1990. - № 5. - С. 38-39.
6.
Лубнин А. Ю., Лукьянов В. И., Салалыкин В. И. и
др. // Там же. - 1994. - № 4. - С. 42-44.
7.
Лубнин А. Ю., Коршунов А. Г., Сазонова О. Б. и
др. // Там же. - 1995. - № 2. - С. 20-23.
8.
Лубнин А. Ю., Шмигельский А. В., Островский А.
Ю. // Анест. и реаниматол. — 1995.
— № 4. — С. 68—70.
9.
Сазонова О. Б., Бородкин С. М., Лубнин А. Ю. и
др. // Там же. - 1991. - № 6. - С. 14-19.
10.
Щекутьев Г. А., Лубнин А. Ю., Баранов О. А. // Там
же. — №3.-С. 11-14.
11. Auer L. М. И
Surg. Neurol. — 1991. — Vol. 35. — P. 158— 168.
12. Cressard P., Sevrain L., Freger P. et al. // Neurochirurgie.
— 1988.-Vol. 34.- P. 157-160.
13. Da Plan R., Pasqualin A., Scienza R. et al. // J. Neurosurg.
Sci. - 1979. - Vol. 23. - P. 102-122.
14. Edelman G. J., Huffman W. E., Charbel F. T. et al. //
Anesth. Analg. - 1997. - Vol. 85. - P. 821-825.
15. Frugoni P., Mauzin E.,
Mingrino S. et al. // Acta Anaesth. Ital.
- 1974. - Vol. 25. - Suppl. - P. 99-117.
16.
Henriksen L.,
Thourshauge C., Harmsen
A. et al.
// Acta Anaesth. Scand. — 1983. — Vol.
27. — P. 62—67.
17. Jobsis F. F. H Science.
- 1977. - Vol. 198. - P. 1264-1267.
18.
Kassell N. F., Sasaki Т., Colohan A. R. T. et al. // Stroke. — 1985. - Vol. 16. - P. 562-572.
19.
Lam A. M. // Can. Anaesth. Soc. J. — 1984. - Vol. 31. - P. S56-S62.
20. Lavine S. D., Masri L. S., Levy M. L. et al. // J. Neurosurg.
— 1997. - Vol. 87. - P. 817-824.
21.
McCormlc P. W., Stewart M., Goetting M. G. et al. // Stroke. — 1991.
- Vol. 22. - P. 596-602.
22. McCormick P. W., Stewart M.,
Goetting M. G. et al. // Crit. Care
Med. - 1991. - Vol. 19. - P. 89-97.
23. McCormic P. W., Stewart M., Lewis G. et al.
// J. Neurosurg.
- 1992. - Vol. 76. - P. 315-318.
24.
McKeating E. G., Monjardino J. R., Signorini D. F. et al. // Anaesthesia.
- 1997. — Vol. 52. — P. 136—140.
25. Sako K., Nakai H., Kawata
Y. et al. // Surg. Neurol. - 1998.
-Vol.49. - P. 316-322.
26.
Smith R. R., Zubkov Yu. N., Tarassoli Y. Cerebral Aneurysms. Microvascular and Endovascular Management. — Berlin, 1994.
27.
Sundt T. M. /I J. Neurosurg. - 1982. - Vol. 56. - P. 753-765.
28. Taylor C. L., Selman W. R.,
Kiefer S. P. et al. // Neurosurgery.
- 1996. - Vol. 39. - P. 893-905.
29.
Wahr J. A., Tremper K. K., Samra S. et al. // J. Cardiothorac. Vase. Anesth. — 1996. - Vol. 10. — P. 406—418.
30. Yundt K. D., Gubb R. L.,
Diringer M. N. et al. // Neurosurgery.
- 1997. - Vol.
40. - P.
442-450.
Поступила
17.04.2000








