ИНТРАОПЕРАЦИОННАЯ АППАРАТНАЯ РЕИНФУЗИЯ ЭРИТРОЦИТАРНОЙ МАССЫ, КАК МЕТОД КРОВОСБЕРЕЖЕНИЯ
Е.С.Горобец, В.В.Громова,
Ю.В.Будейнок, А.Ю.Лубнин
Российский онкологический научный
центр, РАМН,
НИИ нейрохирургии им. Н.Н.Бурденко,РАМН,
Москва
Проблема
операционной кровопотери крайне
актуальна во всех областях хирургии.
Восполнение кровопотери с максимальным
сохранением гомеостаза - одна из наиболее
насущных и непростых проблем
анестезиологии. В клинических условиях
оно сводится к решению двух кардинальных
задач:
1) восполнению объема утраченной крови
до приемлемого уровня преднагрузки сердца,
обеспечивающего достаточный сердечный
выброс и необходимую тканевую перфузию, и
2) восполнению состава, подразумевающего,
прежде всего восстановление необходимых
кислородно-транспортной функции крови,
коагуляционного потенциала и коллоидно-осмотического
давления. Проблема восполнения объема
потерянной крови и ее коллоидно-осмотического
давления более-менее успешно решается
использованием кристаллоидных растворов
и синтетических коллоидов, т.е.
искусственных материалов. Что же касается
поддержания агрегатного состояния крови и
ее кислородно-транспортной функции, то при
большой кровопотере пока не
представляется возможным обойтись без
плазмы и эритроцитов человека. Как и
столетие назад, главным их источником
служит донорская кровь, хотя способы
консервации ее претерпели значительные
изменения. В настоящее время в развитых
странах цельную кровь практически не
используют. Сразу после забора от донора
кровь разделяют по меньшей мере на два
компонента - плазму и эритроциты, плазму
замораживают, а эритроцитную массу
сохраняют при помощи специальных добавок-стабилизаторов
и консервантов. Очень важно отметить, что
замораживание плазмы позволяет не только
сохранять ее в течение длительного
времени, но и активирует чрезвычайно
важные компоненты свертывающей системы,
делая свежезамороженную плазму
уникальным высокоэффективным средством
лечения острых коагулопатических
кровотечений. Консервация эритроцитов
напротив, ухудшает их биологические
свойства, а совершенствование процесса
консервации и консервантов позволяет лишь
удлинять сроки хранения эритроцитной
массы и сводить к минимуму ее "порчу",
что в первую очередь относится к
газотранспортной функции.
В настоящее время,
кажется, все знают об опасностях, которые
таит в себе донорская кровь. Наибольшую
известность приобрели такие грозные
осложнения как гемолиз из-за переливания
крови, несовместимой по группе или резус
принадлежности, и заражение реципиента
больным донором. Куда меньше широкий круг
врачей-клиницистов задумывается об
осложнениях, связанных с отличиями
консервированной донорской крови от
циркулирующей в сосудах крови реципиента.
Два основных фактора определяют неполное
соответствие донорской крови собственной
крови больного: 1) чужеродность ее белковой
структуры неизбежно вызывает
иммунологические реакции с
многочисленными, большей частью скрытыми
последствиями для организма реципиента; 2)
консервация цельной крови или
эритроцитной массы приводит к
множественным изменениям их свойств
негативного характера. По этим причинам
консервированная донорская кровь в
принципе не способна выполнять свои
функции с той же эффективностью, которую
можно ожидать от собственной крови
пациента.
Эти серьёзные недостатки консервированной чужеродной крови заставляют врачей-энтузиастов во многих странах мира искать способы профилактики операционной кровопотери, разрабатывать методы более эффективного лечения ее последствий и искать пути замены донорской крови. В ряде стран применение методов, ограничивающих использование донорской крови в связи с хирургическими вмешательствами, возведено в ранг национального стандарта. К примеру, Консенсусная конференция, состоявшаяся в г. Далласе (США) 12-14 января 1995 г. одним из 11 пунктов рекомендаций по применению крови в хирургической практике констатирует, что в качестве альтернативы переливанию чужеродной крови врач должен предусмотреть возможность использования собственной крови больного [10].
Существуют 4 основных метода "аутодонорства", т.е. использования собственной крови больного для компенсации хирургической кровопотери: предоперационная заготовка крови; острая нормоволемическая гемодилюция; интраоперационный забор крови из операционной раны с ее обработкой и реинфузией и послеоперационный сбор крови из дренажей с обработкой и реинфузией. Данный обзор посвящен описанию только одного из этих методов, позволяющих избежать переливания донорских эритроцитов, либо свести его к минимуму, несмотря на значительную операционную кровопотерю - интраоперационной реинфузии собственных эритроцитов больного, собранных из операционной раны во время хирургического вмешательства или после его окончания и обработанных с помощью специальных аппаратов.
1. Терминология.
Метод интраоперационной реинфузии аутокрови пришел к нам из-за рубежа и в англоязычной литературе имеет 4 варианта названий: наиболее распространенное - intraoperative blood salvage (IBS), а также intraoperative autologous transfusion, intraoperative salvage или intraoperative autotransfusion. Весьма важно обратить внимание тот факт, что повсеместно, как в отечественной и зарубежной литературе, так и в повседневной речи врачей происходят смешение и путаница понятий "кровь" (blood) и "эритроцитная масса" (packed red blood cells). Интересно, что при этом цельную кровь никогда не назовут "эритроцитной массой", однако последнюю сплошь и рядом именуют "кровью". Разумеется, что все, или почти все, в принципе хорошо понимают разницу между этими двумя трансфузионными средами. На первый взгляд эта путаница выглядит достаточно невинной. Однако, опыт показывает, что как всегда за неточностью терминов может следовать нечеткость понимания или просто неправильное толкование прочтенной или услышанной информации. Так случилось и с методом интраоперационной реинфузии аутокрови (intraoperative blood salvage - IBS). На самом деле это не один, а два, хотя и близких, но биологически и технологически совершенно разных метода возвращения оперируемому больному теряемой в процессе хирургического вмешательства крови или получаемых из нее эритроцитов. В одном случае речь идет о сборе крови из операционной раны, фильтрации ее и обратном переливании больному цельной аутокрови. Для этого пользуются либо простейшим оборудованием типа стерильного ковша, кружки и 8 слоев марли, либо специальными устройствами, включающими в себя двухпросветный вакуумный аспиратор и тонкий фильтр. В другом - применяют специальную дорогостоящую высокотехнологичную аппаратуру, с помощью которой хирург собирает из операционной раны изливающуюся кровь, а подготовленный специалист ex tempore приготавливает из нее концентрированные отмытые эритроциты, которые тут же, или в течение ближайших 6 часов возвращают больному. Плазму же крови, как правило, сбрасывают в утиль.
По всей видимости, правильнее было бы называть первый метод "интраоперационной реинфузией крови" (ИРК), а второй - "интраоперационной аппаратной реинфузией эритроцитов" (ИАРЭ).
Для того, чтобы еще раз обратить внимание на практическую важность такого уточнения и разделения терминов, можно добавить наблюдение, согласно которому некоторые хирурги, ощутив по результатам эффективность метода ИАРЭ, полагают, что благодаря ему удается возвращать больному почти всю излившуюся во время операции кровь со всеми ее свойствами и на этом все, по крайней мере трансфузиологические проблемы, им кажутся решенными.
2. История развития интраоперационной реинфузии крови.
Концепция реинфузии крови крови далеко не нова. После того, как 1818 г. J. Blundell был беспомощным наблюдателем маточного кровотечения, он провел серию экспериментов по реинфузии крови на собаках и рекомендовал её для применения у больных. Затем, после долгого перерыва мысль о возвращении крови в сосудистое русло больному высказал в России в 1865 г. В. В. Сутугин [12]. Следующий период интереса к этому методу начался в 1874 г. с исследования William Highmore, который предложил собирать и дефибринировать кровь, излившуюся после родов, затем согревать её до температуры тела и переливать родильнице при помощи шприца Хиггинсона. В январе 1886 г. John Duncan (Edinburg) первым перелил около 100 мл излившейся крови во время ампутации нижней конечности. Антикоагулянтом служил цитрат натрия. В феврале того же года Miller (Edinburg), провёл неосложнённую реинфузию (РИ) при экзартикуляции инфицированного бедренного сустава [41]. Затем, однако, наступил очередной период забвения кровесбережения до тех пор, пока в 1914 году лейпцигский гинеколог Johannes Thies не провёл три успешных РИ при операциях по поводу нарушенной внематочной беременности, после чего процесс внедрения РИ в повседневную хирургическую практику стал массовым [45]. Особенно актуальным этот метод стал в период первой мировой войны. Так в 1916г. Henry и Elliot переливали аутокровь из плевральной полости раненым солдатам [12].
Метод активно
применялся и тщательно изучался в России.
Так, в 1918 г. А. Н. Филатовым была
осуществлена РИ больной с внутрибрюшным
кровотечением при внематочной
беременности. Был доказан факт
дефибринирования крови, остро излившейся
в серозные полости, и ее пригодность для РИ
в первые часы после кровопотери. Уже в 1928 г.
А. Н. Филатов доложил о 574 больных, которым
проводилась интраоперационная РИ, и
отметил осложнения, возникшие в
результате её. Среди последствий РИ были
отмечены озноб, рвота, беспокойство,
желтуха и даже несколько смертельных
исходов. Причину этих осложнений А.Н.
Филатов видел в частности в
несовершенстве методов обработки крови
[12].
В США первая РИ была проведена в1917 году
Lockwood во время спленэктомии при синдроме
Банти. Всего к 1920 году в мировой
медицинской прессе было опубликовано 164
сообщения о применении РИ, а к 1931 их было
уже 282. Так, в частности, в 1931 Brown и Debenheim
применили РИ при гемотораксе. В
нейрохирургии первыми применили РИ L.E.Davis и
H.Cushing в 1925 году в госпитале Peter Bent Brigham. В
статье "Опыт возмещения кровопотери во
время и после интракраниальных операций",
опубликованной в журнале "Surgery, Gynecology and
Obstetrics" они описали первый случай
применения интраоперационной РИ при
нейрохирургическом вмешательстве [12]. 42-х
летний пациент был оперирован по поводу
менингеомы левой затылочной области. По
причине массивного кровотечения опухоль
невозможно было удалить даже в 2 этапа. Во
время третьей по счёту операции 120-ти
граммовая опухоль была удалена, при этом
интраоперационно проводилась РИ 600 мл
крови больного, собранной с помощью
самодельного аспиратора. Не было отмечено
никаких осложнений. В общей сложности Davis и
Cushing провели около 23 успешных
интраоперационных РИ во время
нейрохирургических вмешательств.
Современная эра РИ начинается с середины 60-х годов, когда Richard Dyer сообщил об экспериментальном применении специального стеклянного резервуара с фильтром, куда собирали с помощью вакуум-аспиратора кровь собаки, изливавшуюся в операционную рану. В 1968 г. американский военный хирург Gerald Klebanoff усовершенствовал аппарат Dyer и стал использовать кардиотомный резервуар и роликовый насос DeBakey для сбора, антикоагуляции, фильтрации и реинфузии во время операции крови человека. Klebanoff работал в сотрудничестве с лабораториями Bentley, поэтому первым промышленно выпущенным в 1971 году аппаратом для реинфузии крови стал Bentley ATS 100. Эффективность этой установки была убедительно доказана во время её успешного широкого применения в последующие годы, в частности, во время вьетнамской войны. Однако, в связи с очень упрощённой обработкой крови (только фильтрацией) возникало множество осложнений: из-за трансфузии лизированных эритроцитов повышался уровень свободного гемоглобина, первичная активации свёртывания либо фибринолиза вызывала расстройства гемокоагуляции, развивалась даже почечная недостаточность. Скорость работы аппарата зависела от переливания под давлением, что приводило к воздушной эмболии.
В том же 1968 году J. Wilson и Н. Taswell из клиники Мэйо сообщили о результатах экспериментального применения аппарата для сбора крови из операционной раны, приготавливавшего отмытые эритроциты в физиологическом растворе, пригодные для реинфузии [41]. "Сердцем" этого аппарата была металлическая центрифуга, конструкции Alien Latham, работавшая в прерывистом режиме. В 1969 г. они опубликовали сообщение о первом применении аппарата у 11 больных во время простатэктомии [12]. Первые же коммерческие образцы аппаратов под названием Cell Saver, основанных на этом принципе, выпустила американская фирма Haemonetics в 1974 году. Новые аппараты значительно отличались большим совершенством и безопасностью -с их помощь кровь собирали из операционной раны, стабилизировали, фильтровали, отмывали физиологическим раствором и только после этого полученную эритроцитную массу реинфузировали пациенту [41]. Таким путем собранную кровь очищали от лизированных эритроцитов, свободного гемоглобина, антикоагулянтов, активированных факторов свёртывания, внеклеточного калия, миоглобина, частиц кости, жира и клеточного детрита. Ценой очистки оказалось отделение и удаление вместе с промывающим раствором и плазмы крови. Аппараты быстро завоевали широкую популярность, подобные им образцы, используя центрифугу Latham, начали производить и другие зарубежные фирмы, название же Cell Saver ("спасатель клеток") стало нарицательным.
3. Различные методы интраоперационной реинфузии крови.
Разница методик интраоперационной реинфузии заключается в принципах обработки излившейся крови (Рисунок 1), а также техническом обеспечении каждого метода, от простейшего, с применением подручных средств (ИРК), до самого современного - аппаратной реинфузии отмытых и концентрированных эритроцитов (ИАРЭ).
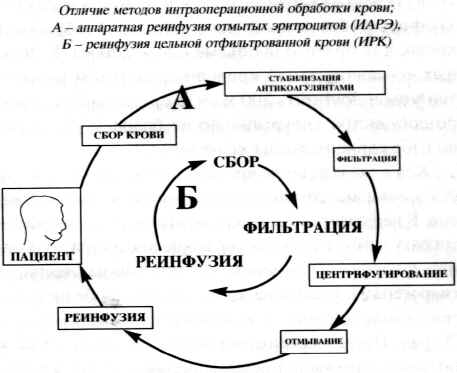
3.1. Простейший
метод [6] .
Простейший метод ИРК состоит в сборе
стерильным ковшом излившейся в полость
организма (брюшную, грудную, перикарда)
крови, в которую добавляют гепарин или
цитрат натрия. Затем раневую кровь
процеживают сквозь несколько (обычно 8)
слоев смоченной в физиологическом
растворе марли и возвращают больному.
Достоинством этого метода можно считать
его быстроту и доступность. С помощью
этого метода были спасены многие тысячи
женщин с нарушенной внематочной
беременностью, а также другие больные и
раненые с массивной внутриполостной
кровопотерей. Главный недостаток метода:
марля - ненадёжный фильтр, способный
задерживать лишь самые крупные сгустки
крови и частицы тканей. Переливаемая же
кровь всегда содержит невидимые глазу
мелкие фрагменты повреждённых тканей,
микроагрегаты форменных элементов крови,
строму лизированных эритроцитов,
лейкоцитов, тромбоцитов и т.п. Фильтры
обычных систем для переливания крови тоже
слишком крупнопористы и не способны
существенно выправить положение. В
процессе переливания приготовленной
таким образом аутокрови закономерно
происходят микроэмболии, последствия
которых не прогнозируемы и каждый раз
зависят от массы случайных причин.
Переливать такую кровь рекомендуется
через лейкоцитарные или другие
микрофильтры с порами размером не более 20 -
40 микрон. Эти фильтры резко замедляют темп
трансфузии, однако не спасают от
поступления в кровоток больного
растворимых биологически активных
веществ, выделившихся во время операции
или травмы из разрушенных тканей и
способных вызвать многочисленные
осложнения, которые рассмотрены ниже. По
современным представлениям, метод
простейшей ИРК может быть применён только
при угрожающих жизни массивных полостных
кровотечениях (например, при нарушенной
внематочной беременности).
3.2. Системы
сбора и фильтрации.
К таким системам относятся
многочисленные варианты аппаратов для
усовершенствования вышеописанной
методики. Различные компании выпускают
промышленные стерильные системы сбора и
фильтрации раневой крови: ИГ-2, Solcotrans, Berkley,
Davol и др. Эти устройства, как правило,
состоят из кардиотомного резервуара с
антикоагулянтом, 260 - 300 микронного фильтра
и шланга подключения вакуум-аспиратора.
Реинфузия происходит прямо из
кардиотомного резервуара через
микрофильтр без всякой дополнительной
обработки крови, как правило, в объеме
около 250 мл. У больных со значительной
кровопотерей объём реинфузии может
достигать 200 мл/ч (в ортопедии и сердечно-сосудистой
хирургии), но не более 1,5-2 литров во
избежание развития коагулопатий.
Как показали исследования, кровь, взятая из полости организма, сохраняет стерильность в течение 6 часов. В ней содержатся микроагрегаты, растворены антикоагулянты, высоко содержание продуктов деградации фибрина, D-димеров, креатинкиназы, лактатдегидрогеназы, увеличена концентрация свободного гемоглобина, активность плазмина превышает норму в 20 раз. После переливания необработанной крови у больного отмечается повышение активности плазмина, плазминогена и антиплазмина. Из-за контакта собранной крови с чужеродными материалами активируется система комплемента с выбросом анафилатоксинов СЗа и С5а, конечных комплексов комплемента, которые при реинфузии индуцируют выработку лизосомальных ферментов, интерлейкинов, простагландинов в макрофагах. Вследствие попадания вышеперечисленных биологически активных веществ в сосудистое русло при реинфузии цельной крови, возможно развитие тромбоцитопении, ДВС-синдрома, послеоперационной кровоточивости, РДСВ, почечной недостаточности и даже полиорганной недостаточности. Таким образом, переливание цельной аутокрови может вместо лечебного действия обернуться тяжелыми и трудно прогнозируемыми осложнениями.
4. Аппаратная реинфузия отмытых эритроцитов.
Проблему осложнений, связанных с попаданием в кровоток частиц разрушенных тканей и выделившихся из них биологически активных веществ можно решить путем сепарации крови на эритроцитную массу и плазму с последующим отмыванием эритроцитов достаточно большим объемом физиологического раствора. Правда, в этом случае очищенными оказываются только эритроциты, которые в виде их взвеси в физиологическом растворе пригодны для вполне безопасного возврата в кровеносное русло больного. Таким путем удается достичь одной из целей восполнения кровопотери - восстановления кислородно-транспортной функции крови. Плазма же крови, вместе с промывными водами уходит в утиль и безвозвратно утрачивается. По этой причине, решить другие важнейшие задачи компенсации кровопотери - восстановление коллоидно-онкотического давления и коагуляционного потенциала крови с помощью классического Cell Saver'a не удается.
4.1. Сбор и
обработка крови.
Сбор: Сбор крови из операционной раны
производят с помощью специального
двухканального шланга, в один канал
которого поступает физиологический
раствор с добавлением антикоагулянта (гепарина
или цитрата натрия), а через второй -
стабилизированная кровь засасывается с
помощью вакуум-аспиратора в кардиотомный
резервуар. Смешивание крови со
стабилизатором происходит в наконечнике
шланга. Степень разрежения вакуум-аспиратора
подбирают так, чтобы при максимальной
скорости всасывания, минимально
травмировать эритроциты.
Фильтрация: Первичная очистка
стабилизированной крови от сгустков и
примесей
происходит при помощью фильтра с порами в
260 микрон при поступлении в кардиотомный
резервуар. Затем следует аппаратная
обработка крови, которая может
происходить в ручном или автоматическом
режиме. Основные этапы обработки: -заполнение;-отмывание;-опорожнение.
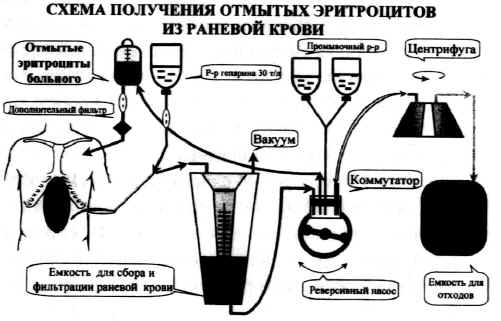
Заполнение: На этапе заполнения кровь с помощью роликового насоса поступает в колокол центрифуги, где происходит отделение эритроцитов от загрязнённой плазмы и других клеток крови.
Процесс сепарации основан на разной плотности клеточных или жидкостных составляющих обрабатываемой крови (таблица № 1). Наиболее плотные клеточные элементы, такие как эритроциты, часть нейтрофилов, метамиелоцитов и ретикулоцитов из-за особого устройства колокола оседают при центрифугировании на его внешней стенке, тогда как менее плотные клетки крови всплывают и удаляются через специальные каналы в мешок для отходов.
Таблица 1. Относительная плотность форменных элементов крови.
| Элементы крови | Относительная плотность |
| Плазма | 1.025-1.029 |
| Тромбоциты | 1.040 |
| Лимфоциты | 1.050-1.061 |
| Бласты. Промиелоциты | 1.058-1.066 |
| Моноциты | 1.065-1.066 |
| Миелоциты. Базофилы | 1.070 |
| Ретикулоциты | 1.078 |
| Метамиелоциты | 1.080 |
| Нейтрофилы | 1.087-1.092 |
| Эритроциты | 1.078 |
Процедура продолжается до образования эритроцитной массы с гематокритом 55-65 %. После этого начинается следующий этап - отмывание.
Отмывание: В тот же колокол центрифуги с помощью роликового насоса поступает промывающая среда - 0,9 % раствор NaCI или раствор Рингера. Раствор омывает эритроциты и вытесняет загрязнённую плазму вместе с гепарином или цитратом натрия, свободным гемоглобином, факторами свертывания, клеточными детритом и другими примесями в мешок для отходов. Процедура повторяется, пока все нежелательные компоненты не будут удалены.
Опорожнение: После этого отмытые, концентрированные эритроциты с помощью роликового насоса перекачиваются в мешок для готовой аутоэритромассы. Теперь их можно переливать пациенту.
5. Достоинства метода
интраоперационной аппаратной реинфузии
отмытых аутоэритроцитов.
Достоинства метода
ИАРЭ можно представить как:
1. Характерные для способа,
обеспечивающего быстрый возврат в
кровоток
эритроцитов, теряемых во время операции.
Это: принципиальная возможность
выполнения хирургических вмешательств,
связанных с большой и стремительной
кровопотерей, в том числе у больных с
редкими группами крови; спасение жизни
больного при внезапном профузном
кровотечении; снижение частоты
переливания и доз донорской крови;
снижение риска развития синдрома "массивных
гемотрансфузий".
2. Свойственные применению именно
отмытых эритроцитов, освобожденных от
вредных примесей, т.е. отсутствие или
резкое снижение риска: коагулопатий,
связанных с попаданием в кровоток
растворимых и нерастворимых
тромбопластических веществ из
поврежденных форменных элементов и тканей,
а также стабилизаторов (гепарина или
цитрата натрия); микротромбоэмболий и
вообще микроэмболий; последствий
переливания среды, содержащей свободный
гемоглобин (прежде всего - ОПН).
Говоря о достоинствах метода ИАРЭ, следует обратить внимание на то, что при необходимости обширных хирургических операций с ожидаемой массивной или даже экстремальной кровопотерей, у хирургов появилась возможность решаться на подобные вмешательства с высокими шансами на успех их переносимости. Наблюдения последних лет, проведенные в Российском онкологическом научном центре РАМН, показали, что после операций, сопровождавшихся кровопотерей от 50 до 850% ОЦК, в зависимости от включения в инфузионно-трансфузионную программу ИАРЭ, удавалось сократить срок применения ИВЛ в среднем на 2 суток, в 2 раза снизилась продолжительность лечения больных в отделении реанимации. Летальность после операций, осложнившихся массивной кровопотерей, без использования ИАРЭ составила 17,8%, при использовании- 5,4%.
Преимущества метода очевидны. С другой стороны, трудно выделить какой-либо один благотворный фактор, определяющий его эффективность. По-видимому, это прежде всего быстрое, пусть неполное, восстановление кислородной емкости крови за счет собственных эритроцитов пациента, немедленно включающихся в транспорт кислорода, не вызывающих значимых иммунных реакций, и не подвергшихся сколько-нибудь длительной консервации. Поскольку основная масса осложнений реинфузии связана с попаданием в кровеносное русло пациента плазмы, содержащей нежелательные примеси, то избавление реинфузата от подобной плазмы избавляет пациента от этих осложнений.
Центрифугирование и отмывание аутоэритромассы можно производить и без применения дорогостоящей аппаратуры. Но, во-первых, использование Cell Saver'ов во много раз ускоряет процесс обработки, что жизненно важно при массивной кровопотере. Во-вторых, ультразвуковые и инфракрасные датчики аппаратов позволяют осуществлять тонкий контроль над качеством эритромассы, практически недоступный при обработке вручную. Современные аппараты позволяют достичь такой степени очистки эритроцитной массы, что появилась возможность применять Cell Saver в ситуациях, ранее числившихся в списке противопоказаний для реинфузии: при загрязнении крови амниотической жидкостью, содержимым тонкого кишечника и т. п.
6. Недостатки аппаратной реинфузии.
Главный недостаток Cell Saver'ов - высокая стоимость аппаратуры и расходных материалов к ней. Стоимость последних для одной процедуры реинфузии составляет порядка 120-150 американских долларов. В плане перспективы широкого внедрения метода в нашей стране, где, помимо жестокого дефицита средств, не принято принимать в расчет несиюминутные, непрямые и неочевидные расходы, эта цифра оставляет тяжелое впечатление.
Кроме того, ИАРЭ пока еще страдает рядом технических несовершенств. Невозможность сохранить плазму крови и тромбоциты приводит к потере факторов свёртываемости и нарушениям гемостаза. Вместе с плазмой теряются и иммуноглобулины - Ig G, Ig А и Ig М, альбумин и другие белки крови со всеми вытекающими последствиями.
Гемолиз может оказаться серьёзной проблемой ИАРЭ. К разрушению эритроцитов могут приводить многие факторы: а) особенности техники аспирации раневой крови (максимальным разрушающим действием на эритроциты обладает ультразвуковой аспиратор), б) слишком сильное разрежение отсоса, в) контакт эритроцитов с инородными материалами и воздухом, г) турбуленция, возникающая в трубках аспиратора и кардиотомном резервуаре, д) коагуляция, е) недостаточное отмывание эритромассы, ж) слишком интенсивная работа роликовых насосов, з) недостаток глюкозы для питания эритроцитов.
Множество
различных примесей попадает в раневую
кровь и поступает в кардиотомный
резервуар при сборе ее хирургическим
аспиратором: ткани и жидкости организма,
частицы материалов из которых сделаны
хирургическое белье, расходные
принадлежности, инструменты и т.п.
Процедура обработки крови в аппарате типа
Cell Saver не может полностью гарантировать их
удаление при центрифугировании и
отмывании, если плотность частиц выше
плотности плазмы крови. К таким примесям
относятся микроагрегаты крови, микробы и
клетки опухолей Обычные фильтры систем
для переливания крови с порами размером
120-170 мкм их не задерживают. По этой причине
рекомендуют использовать более тонкие (40
мкм) или "супертонкие" микропористые
лейкоцитарные фильтры. Надо отметить, что
только последние способны полностью
предотвратить попадание в кровоток клеток
злокачественных опухолей вместе с
возвращаемой эритроцитной массой. Другое
дело, что само по себе попадание в
сосудистое русло опухолевых клеток отнюдь
не равнозначно появлению метастазов
опухоли [33]. Применение тонких фильтров
значительно замедляет процесс
переливания, что делает их мало
приемлемыми в случае массивной
одномоментной кровопотери. Кроме того,
тонкие фильтры достаточно дороги. Всё
вышеперечисленное даёт широкое поле
деятельности разработчикам
усовершенствованной аппаратуры для
интраоперационной РИ.
7. Сравнительная характеристика различных
типов аппаратов для ИАРЭ.
Различные типы аппаратов для ИАРЭ
разработанны целым рядом ведущих фирм,
работающих в области медицинской
аппаратуры: CATS® (Fresenius), Cell Saver® (Haemonetics}, BRAT® (СОВЕ),
Solcotrans®, Plus Intraoperative System (Davol), Sorensen, Compact, STAT™ (Dideco/Shiley/Sorin),
Bloodstream™ (Harvest), Sequestra™, Bloodless Surgery Workstation (Medtronic/Electromedics),
Autovac BP™ (Boehringer) широко используются
практически во всех областях
анестезиологии и хирургии. Эти аппараты
можно условно разделить на две группы: с
прерывистым циклом обработки крови и
непрерывного действия. Попытаемся оценить
положительные и отрицательные стороны
каждой конструкции.
7.1. Аппараты
дискретной обработки аутокрови.
К ним относятся, в частности, Cell Saver® (Haemonetics),
BRAT® (СОВЕ), STAT™ (Dideco/Shiley/Sorin). Рассмотрим
принцип их работы на примере Cell Saver® (Haemonetics).
Аппарат имеет
следующие режимы обработки: ручной (Manual) и
автоматический (Auto). Автоматический может
быть: стандартным (Normal), ортопедическим (Orthopedic)
и малообъёмным (Low Volume). "Стандартный"
режим может быть запрограммирован на 1-2-3
цикла отмывания. "Ортопедический"
предусматривает возможность менять
объёмы моющего раствора и скорость насоса.
"Малообъёмный" режим используется в
сочетании с меньшим по объёму колоколом
центрифуги в случаях, когда не предвидится
большой кровопотери.
Особенностью этих систем является то, что
они имеют один роликовый насос. Поэтому
каждый цикл выполняется отдельно. Сначала
насос заполняет систему моющим раствором,
затем собранной кровью, после этого идет
процесс сепарации, затем насос снова
накачивает раствор - процесс повторяется
до полного отмывания. Наконец, насос
опорожняет систему от готовой эритромассы,
и всё начинается снова.
Преимущества. Преимуществом данных систем можно считать возможность контролирования процесса оператором. Такая возможность даётся режимом Return (возврат), когда при недостаточном качестве промывания эритромассы оператор может повторить цикл отмывания до оптимального результата. Кроме того, программа ручного отмывания (Manual) даёт полный простор для контроля оператора над процессом обработки эритромассы.
Недостатки. Недостатком принципа ступенчатой обработки является более медленное, по сравнению с непрерывной, функционирование системы. Например, при экстренной ситуации (профузное кровотечение), когда кардиотомный резервуар наполняется очень быстро, аппарат может не успевать обрабатывать эритромассу и опорожнять резервуар. Кроме того, поступление загрязнённой раневой крови и эвакуация готовой эритромассы осуществляются через один и тот же канал, так как эти системы имеют единственный роликовый насос. В результате качество очистки реинфузата значительно снижается (на 32-37 %) [21].
7.2. Аппараты
непрерывной обработки.
К ним относится система CATS®(Fresenius).
Одна из последних моделей - CATS-2.02 имеет в
своём распоряжении следующий спектр
режимов:
o "Малообъёмный" (Low Volume Wash) -
тщательная обработка малых объёмов крови.
Рекомендуется для педиатрии. 7 циклов
отмывания.
o "Высококачественный" (High Quality Wash) -
тщательная обработка загрязнённой крови. 7
циклов отмывания.
o "Качественный" (Quality Wash) - стандартная
программа интра- и послеоперационной
обработки как раневой, так и дренажной
крови. 5 циклов отмывания.
o "Ускоренный" (High Flow Wash) - для
обработки чистой крови при массивной
одномоментной кровопотере. 3 цикла
отмывания. Поток эритромассы - 30-70 мл/мин.
o "Быстрый" (Ultra Flow Wash) - для обработки
чистой крови при массивной одномоментной
кровопотере. 1 цикл отмывания. Поток
эритромассы - 50-100 мл/мин.
o "Срочный" (Emergency Wash) - максимальная
скорость обработки. 1 цикл отмывания. Поток
эритромассы - 50-100 мл/мин.
o "Экстренный 190" (Blood Transfer 190) - работает
как система сбора и фильтрации в ургентных
случаях. Кровь только фильтруется и
перегоняется из кардиотомного резервуара
в мешок для реинфузии со скоростью 100-190 мл/мин.
Кровь не отмыта и не концентрирована.
o "Экстренный 350" (Blood Transfer 350) - то же
самое, только скорость перегонки
повышается до 200-350 мл/мин.
o "Крио-режим" (Cryo Wash) - обработка
свежезамороженных эритроцитов с
применением 20 % глицерина.
o "Непрямая сепарация" (Plasma Sequestration) -
сепарация собранной и стабилизированной
крови на эритромассу, плазму и тромбомассу.
o "Прямая сепарация" (PSQ) - сепарация
крови из прямого венозного доступа на
эритромассу, плазму и тромбомассу.
В данной системе используются три роликовых насоса, позволяющие производить одновременную, а потому непрерывную обработку крови. Один насос заполняет колокол моющим раствором, другой - собранной кровью, а третий - перекачивает готовую эритромассу в пакет для реинфузии. При этом не прекращаются процессы сепарации и отмывания в центрифуге, что обеспечивает особое устройство колокола.
Все стадии
цикла полностью автоматизированы.
Преимущества. Преимуществом данной
системы, кроме богатства и разнообразия
возможностей, предоставляемых её
программным обеспечением, по мнению
авторов [14], является, во-первых,
непрерывность, а, следовательно - более
высокая скорость обработки крови. Во-вторых,
благодаря наличию раздельных каналов
поступления в обработку загрязненной
крови и эвакуации готовой эритромассы,
степень очистки конечного продукта
оказывается выше, нежели при работе с
системами типа "Cell Saver 4" [21]. Кроме того,
при любом режиме оператор может изменить
скорость работы насосов с помощью софт-клавиатуры,
что позволяет ускорить или замедлить, для
большей тщательности, обработку
эритромассы.
Недостатки. Обратная стороной медали
полной автоматизации процесса и полного
отсутствия ручного режима - невозможность
корригировать процесс отмывания
эритроцитов. Оператор должен предвидеть и
выбрать заранее режим обработки крови
Например, в случае обнаружения большого
количества свободного гемоглобина в
промывной жидкости он не может повторить
процесс промывания. Это чревато введением
контамината в сосудистое русло пациента с
развитием последующих осложнений.
8. Абсолютные и относительные противопоказания к ИАРЭ.
По решению 25 съезда Международного трансфузиологического общества (27 июня - 2 июля 1998 г.) интраоперационная реинфузия крови абсолютно противопоказана при ее загрязнении: гноем; содержимым толстого кишечника; веществами, противопоказанными к введению в сосудистое русло (например - антибиотики, не разрешённые к парентеральному применению, бетадин, перекись водорода, дистиллированная вода, спирт, авитен, гемостатические препараты на основе коллагена) [75].
Отдельным интересным вопросом являются особенности и ограничения РИ у больных с различными заболеваниями крови [19]. Относительными противопоказаниями для интраоперационной аппаратной РИ считаются примесь амниотической жидкости, содержимого тонкого кишечника, онкология, когда решение о возможности использования интраоперационной РИ принимает врач [53]. В настоящее время ведутся исследования по разработке методов, способствующих расширению спектра применения РИ при условиях, являющихся в настоящий момент противопоказаниями для использования данной методики [4].
9. Осложнения аппаратной реинфузии. Их профилактика и лечение.
В результате интраоперационной обработки раневой крови получается эритроцитная масса из отмытых эритроцитов, по своим качествам практически не отличающаяся от отмытых эритроцитов, приготавливаемых отделениями переливания крови для снижения риска иммунных реакций.
Хорошо известны недостатки такой эритроцитной массы - ее нестабильность и, соответственно, резкое укорочение срока хранения, а также хрупкость эритроцитов и примесь частично разрушенных клеток. Специфические же особенности эритроцитной массы, приготовленной аппаратами типа Cell Saver - возможное присутствие свободного гепарина, загрязняющих частиц и жидкостей из операционной раны. Эти, практически неизбежные при нынешней технологии ИАРЭ недостатки, изредка приводят к осложнениям:
Коагулопатии. Отмытые эритроциты не активируют плазматические факторы свёртывания, но, тем не менее, существуют сообщения о серьезных посттрансфузионных нарушениях гемостаза. Авторы объясняют их присутствием конгломератов из лейкоцитов и тромбоцитов при неправильно выбранном режиме обработки крови. Для активации свёртывания характерно укорочение АЧТВ. С целью профилактики попадания лейкоцитарных и тромбоцитарных конгломератов рекомендуют применение современных лейкоцитарных фильтров (например, фильтра RC-400 фирмы Pall). Коагулопатии, связанные с неполным отмыванием стабилизаторов крови (гепарина или цитрата натрия) весьма редки и появляются при поспешной и недостаточной обработке крови. Удлинение АЧТВ или тромбинового времени должно насторожить врача и может быть сигналом для использования антагонистов. В рамках настоящего сообщения мы не рассматриваем коагулопатии, возникающие вследствие массивной кровопотери как таковой.
Гемолиз. Механическая обработка крови, даже очень щадящая, пропускание ее через роликовый насос и длинные магистрали всегда чреваты развитием гемолиза. Токсическое действие свободного гемоглобина на эпителий почечных канальцев может привести к развитию острой почечной недостаточности. Профилактика гемолиза состоит в тщательном отмывании крови. Следует обратить особое внимание на технологию ее сбора. Она состоит не только в ограничении степени разрежения в вакуум-аспираторе. Гемолиз увеличивается, если для увеличения количества собираемой крови выжимают салфетки и т.п. При заметном гемолизе следует стремиться к повышению почечного кровотока, в том числе с использованием осмодиуретиков (может быть эффективен реоглюман) и ощелачивать плазму крови больного.
10. Особенности применения реинфузии в различных областях хирургии.
За рубежом ИАРЭ получила распространение во многих отраслях хирургии: сердечно-сосудистой, трансплантологии, акушерстве и гинекологии, ортопедии и травматологии, хирургии печени, детской хирургии. Накапливается опыт применения метода в некоторых областях онкохирургии. ИАРЭ постепенно появляется и в отечественных лечебных учреждениях, причем если еще недавно ею пользовались исключительно в кардиохирургических клиниках России, то теперь метод стали использовать и в других областях хирургии. Специфика каждой из этих областей подразумевает особенности применения метода ИАРЭ.
Заключение.
Метод ИАРЭ на основе применения специальных аппаратов типа Cell Saver -высокоэффективный способ возврата в кровоток эритроцитов, утраченных во время операции, в особенности в тех ситуациях, когда кровопотеря носит острый и массивный характер, о чём свидетельствует клинический опыт, накопленный в различных областях хирургии. Дальнейшее развитие метода, в особенности создание способа реинфузии очищенной плазмы крови, совершенствование техники и технологии, минимизация побочных эффектов может сделать его оптимальной альтернативой переливанию донорской крови.
Л И Т Е Р А Т У Р А
1. Горобец Е.С.,
Буйденок Ю.В., Костяк О.С. и др. Опыт
применения аппаратной реинфузии
эритроцитов при массивной кровопотере у
онкологических больных. Доклад на
заседании Московского научного общества
анестезиологов и реаниматологов от 20.05.1997.
2. Дементьева И.И. Преимущества, опасности и
перспективы использования аутологичной
крови операциях аорто-коронарного
шунтирования.// Анест. Реан. 1997. No 1 c. 87-89.
3. Добровольская Л.С. Вспомогательное
кровообращение и проблема травмы крови.
Дисс. канд. мед. наук. Москва. 1980.
4. Козлов И.А., Хубутия М.Ш., Киров М.Ю.
Фильтры. Сообщение 3.// Вест. Интенс. Тер. 1997.
No 4 c.20-26.
5. Лубнин А.Ю., Тома Г.И., Полонская М.Е., и др.
Динамика показателей гемостаза на фоне
изоволемической гемодилюции у
нейрохирургических больных.// Пробл.
гематол. перелив. Крови. 1998. №1 с.13-17.
6. Практическая трансфузиология. Под ред.
Козинца Г.И. М., 1997, с.251-255.
7. Черкас Д.Д. Сравнительная оценка влияния
различных экстракорпоральных систем на
гемокоагуляционный статус
кардиохирургических больных. Дисс. канд.
мед. наук. Ленинград. 1989.
8. Шандер А. Анестезиологическая тактика и
фармакологические средства для
ограничения периоперационной кровопотери.//
Анест. и Реан. Приложение: "Материалы
симпозиума: Альтернативы переливанию
крови в хирургии". 1999. c.68-80.
9. Aufeuvre J.P. Transfusion et cancer.// Transf. Clin. Biol. 1994. V.1
p.237-246.
10. Autologous haemotherapy. Hempelmann G, Dietrich G. eds. Biermann. 1994.
11. Autotransfusion machines.// Health Devices. 1988. V.17 p.219-242.
12. Bartels C., Bechtel J.V.M., Winkler C., et al. Intraoperative
autotransfusion in aortic surgery: Comparison of whole blood autotransfusion
versus cell separation.// J. Vasc. Surg. 1996. V.24 p.102-108.
13. Bengtsson A., Avall A., Tylman M., et al. Effect on complement activation
of a new continuous autotransfusion system.// Transfus. Med. 1997. V.7
p.107-113.
14. Bengtson J.P., Backman L., Stenqvist O. et al. Complement activation and
reinfusion of wound drainage blood.// Anesthesiology. 1990. V.73 p.376-380.
15. Bernstein H.H., Rosenblatt M.A., Gettes M., et al. The ability of the
Haemonetics 4 Cell Saver System to remove tissue factor from blood
contaminated with amniotic fluid.// Anesth. Analg. 1997. V.85 p.831- 833.
16. Bhasin R., Mahapatra A.K., Banerji A.K. Autotransfusion in neurosurgical
operations.// J. Indian. Med. Assoc. 1993. V.91 p.62-163.
17. Bland L.A., Villarino M.E., Arduino M.J., et al. Bacteriologic and
endotoxin analysis of salvaged blood used in autologous transfusions during
cardiac operations.// J. Thorac. Cardiovasc. Surg. 1992. V.103 p.582-588.
18. Brown M.R., Ramsay M.A., Swygert T.H.. Exchange autotransfusion using the
cell saver during liver transplantation.// Anesthesiology. 1989. V.70
p.168-169.
19. Brajtbord D., Johnson D., Ramsay M., et al. Use of the cell saver in
patients with sickle cell trait. // Anesthesiology. 1989. V.70 p.878-879.
20. Cataldi S., Bruder N., Dufour H., et al. Intraoperative autologous blood
transfusion in intracranial surgery.// Neurosurgery. 1997. V.40 p.765-772.
21. Columb M.O.. Inappropriate heparinization with a cell saver.// Br. J.
Anaesth. 1991. V.67 p.223.
22. Connor J.P., Morris P.C., Alagoz T., et al. Intraoperative autologous
blood collection and autotransfusion in the surgical management of early
cancers of the uterine cervix.// Obstet. Gynecol. 1995. V.86 p.373-378.
23. Dale R.F., Kipling R.M., Smith M.F., et al. Separation of malignant cells
during autotransfusion.// Br. J. Surg. 1988. V.75 p.581.
24. Deleuze P., Intrator L., Liou A., et al.. Complement activation and use of
a cell saver in cardiopulmonary bypass.// ASAIO Trans. 1990. V.36 p.M179-181.
25. Durand F., Duchesne-Gueguen M., Le Bervet J.Y., et al. Etude rheologique
et cytologique du sang autologue recueilli par le "Cell Saver 4" au
cours de cesarienne.// Rev. Fr. Transfus. Hemobiol. 1989. T.32 p.179-191.
26. Duwig I., Camberlein V., Irrman C., et al. Deformabilite et hemolyse des
globules rouges traites par ''Cell-Saver''.// Rev. Fr. Transfus. Hemobiol.
1989. T.32 p.67-68.
27. Edelman M.J., Potter P., Mahaffey K.G., et al.. The potential for
reintroduction of tumor cells during intraoperative blood salvage: reduction
of risk with use of the RC-400 leukocyte depletion filter.// Urology. 1996.
V.47 p.179-181.
28. Endresen G.K.M., Spiechowicz J., Pahle J.A., et al. Introperative
autotransfusion in reconstructive hip joint surgery of patients with reumatoid
arthritis and ankylosing spondilitis.// Scand. J. Reumatol. 1991. V.20
p.28-35.
29. Florio G., Valbonesi M., Lercari G., et al. The Fresenius continuous
autotransfusion system (CATS): preliminary studies and application.// Int. J.
Artif. Organs. 1996. V.19 p.431-434.
30. Gaudiche O., Loose J.P., Egu J.F., et al.. Autotransfusion par Cell Saver
III. Experience de 90 cas de chirurgie du rachis chez l'enfant et adolescent.//
Cah. Anesthesiol. 1988. T.36 p.451-457.
31. Goscinski I., Danilewicz B., Pawliszyn W. et al. Autotransfusion in
neurotraumatology and neurosurgery.// Neurol. Neurochir. Pol. 1995. V.29
p.39-43.
32. Grafitieau J.P., Barr J. Technique transfusionelle en neurochirurgie:
hemodilution normovolemique ou autotransfusion?// Ann. Fr. Anesth. Reanim.
1995. T.14 p.378-379.
33. Guerrero M., Riou B., Arock M., et al. Effets de l'autotransfusion
postoperatoire au cours de la chirurgie prothetique de hanche avec le
dispositif ConstaVacЩ.// Ann. Fr. Anesth. Reanim. 1993. T.12 p.11-16.
34. Hall R.I., Schweiger I.M., Finlayson D.C. Transfusion using a cell saver
apparatus during surgery for coronary artery disease: is it beneficial?// Can.
J. Anaesth. 1990. V.37 p.S155.
35. Hall R.I., Schweiger I.M., Finlayson D.C. The benefit of the Hemonetics®
cell saver apparatus during cardiac surgery.// Can. J. Anaesth. 1990. T.37
p.618-623.
36. Homann B. Autotransfusion with Sorensen apparatus.// Anaesthesist. 1983.
Bd.32 S.538-544.
37. Horst H.M., Dlugos S., Fath J.J. et al. Coagulopathy and intraoperative
blood salvage (IBS).// J. Trauma. 1992. V.32 p.646-653.
38. Jimenez D.F., Barone C.M. Intraoperative autologous blood transfusion in
the surgical correction of craniosynostosis.// Neurosurgery. 1995. V.37
p.1075-1079.
39. Kalfon F., Beaumont J.L., Fournel J.J., et al.. [Transfusional strategy in
neurosurgery: preoperative hemodilution by erythrocytapheresis].// Ann. Fr.
Anesth. Reanim. 1994. T.13 p.798-806.
40. Kang Y., Aggarwal S., Virji M., et al. Clinical evaluation of
autotransfusion during liver transplantation.// Anesth. Analg. 1991. V.72
p.94-100.
41. Kasper S.M., Kasper A.S. History of autologous blood transfusion in the
19th century.// Zentralbl. Chir. 1996. Bd.121 S.250-257.
42. Kearney A., Rosales J.K., Howes W.J. Craniosinostosis: an assessment of
blood loss and transfusion practices.// Can. J. Anaesth. 1989. V.36 p.473-477.
43. Kent P., Ashley S., Thorley P.J., et al. 24-hour survival of
autotransfused red cells in elective aortic surgery: a comparison of two
intraoperative autotransfusion systems.// Br. J. Surg. 1991. V.78 p.1473-1475.
44. Klimberg I., Sirois R,, Wajsman Z.,et al. Intraoperative autotransfusion
in urologic oncology.// Arch. Surg. 1986. V.121 p.1326-1329.
45. Kongsgaard U.E., Wang M.Y., Kvalheim G. Leucocyte depletion filter removes
cancer cells in human blood.// Acta Anaesthesiol. Scand. 1996. V.40 p.118-120.
46. Lassie P., Sztark F., Petitjean M.E. et al. Autotransfusion avec du sang
d'hemothorax a l'aide du dispositif ConstaVac(tm).// Ann. Fr. Anesth. Reanim.
1994. T.13 p.781-784.
47. Lefevre P., Begou D., Vincentelli F., et al. L'autotransfusion par
recuperation peroperatoire en neurochirurgie. Etude preliminaire a propos de
40 malades.// Neurochirurgie. 1989. T.35 p.217-221.
48. Lisander B., Ivarsson I., Jacobsson S.-A. Intraoperative autotransfusion
is associated with modest reduction of allogenic transfusion in prosthetic hip
surgery.// Acta Anesthesiol. Scand. 1998. V.42 p.1-6.
49. Long G.V., Glover J.L., Bendick P.J., et al. Cell washing versus immediate
reinfusion of intraoperatively shed blood during abdominal aortic aneurysm
repair.// Am. J. Surg. 1993. V.166 p.97-101.
50. McNulty S.E., Sharkey S.J., Asam B., et al. Evaluation of STAT-CRIT
hematocrit determination in comparison to Coulter and centrifuge: the effects
of isotonic hemodilution and albumin administration.// Anesth. Analg. 1993.
V.76 p.830-834.
51. McShane A.J., Power C., Jackson J.F. et al. Autotransfusion: quality of
blood prepared with a red cell processing device.// Br. J. Anesth. 1987. V.59
p.1035-1039.
52. Merville C., Charlet P., Zerr C. Utilisation du Cell Saver Haemolite en
chirurgie cardio-vasculaire.. // Cah. Anesthesiol. 1990. T.38 p.537-540.
53. Merville C., Charlet P., Zerr C., et al. Efficacite respective du Cell
Saver® et de la recuperation du circuit de CEC ultrafiltre en chirurgie
cardiaque.// Ann. Fr. Anesth. Reanim. 1991. T.10 p.548-553.
54. Miller G.V., Ramsden C.W., Primrose J.N. Autologous transfusion: an
alternative to transfusion with banked blood during surgery for cancer.// Br.
J. Surg. 1991. V.78 p.713-715.
55. Moor K.L., Bendick P.J., Broadie T.A. et al. Systemic effects of
intraoperative autotransfusion.// Med. Instrum. 1983. V.17 p.85-87.
56. M(ller M., Kuhn D., Hinrichs B., et al. Ist die elimination von
osteosarcomezellen durch "maschinelle autotransfusion" und
leukozyten-depletionsfilter m(glich?// Anaestesist. 1996. Bd.45 S.834-838.
57. Murray D.J., Gress K., Weinstein S. Coagulopathy after reinfusion of
autologous scavenged red blood cells.// Anesth. Analg. 1992. V.75 p.125-129.
58. Murray D.J., Pennell B.J., Weinstein S.L., et al. Packed red cells in
acute blood loss: dilutional coagulopathy as a cause of surgical bleeding.//
Anesth. Analg. 1995. V.80 p.336-342.
59. Olsen J.B., Alstrup P., Madsen T. Open-heart surgery in Jehovah's
Witnesses.// Scand. J. Thorac. Cardiovasc. Surg. .1990. V.24 p.165-169.
60. Perseghin P., Vigano M., Rocco G., et al.. Effectiveness of leucocyte
filters in reducing tumor cell contamination after intraoperative blood
salvage in lung cancer patients.// Vox Sang. 1997. V.72 p.221-224.
61. Perttila J., Leino L., Poyhonen M., et al. Leucocyte content in blood
processed by autotransfusion devices during open-heart surgery.// Acta
Anaesthesiol. Scand. 1995. V.39 p.445-448.
62. Pisters L.L., Wajsman Z.. Use of predeposit autologous blood and
intraoperative autotransfusion in urologic cancer surgery.// Urology. 1992.
V.40 p.211-215.
63. Riou B., Arock M., Guerrero M., et al. Haematological effects of
postoperative autotransfusion in spinal surgery.// Acta Anaesthesiol. Scand.
1994. V.38 p.336-341.
64. Seltzer D.G., Brown M.D., Tompkins J.S., et al. Toward the elimination of
homologous blood use in elective lumbar spine surgery.// J. Spinal. Disord.
1993. V.6 p.412- 421.
65. Tate D.E., Friedman R.J. Blood conservation in spinal surgery. Review of
current techniques.// Spine. 1992. V.17 p.1450-1456.
66. Tessier C., Denninger M.H., Vanoverberghe D. et al. Etude preliminaire de
l'utilisation d'une pompe d'autotransfusion dans l'exerese des meningiomes.//
Ann. Fr. Anesth. Reanim. 1995. T.14 p.R351.
67. The 25th Congress of International Society of Blood Transfusion. Oslo.
June 27-July 2, 1998.// Vox Sang. 1998. V.74. Suppl. 1 pp. 203-239.
68. Thompson H.W., Luban N.L.C. Autologous blood transfusion in the pediatric
patient.// J. Ped. Surg. 1995. V.30 p.1406-1411.
69. Varga Z.R., Thompson J.F., Locke-Edmunds J.C. et al. Clinical and
experimental studies of intraoperative autotransfusion using a new filtration
device.// Br. J. Surg. 1995. V.82 p.765-769.
70. Vignon D. Autologous transfusion: protocols. Материалы
международного сателлитного симпозиума
"Альтернативы переливанию крови.".
Москва. 6 октября, 1998.
71. Wiesel M., Carl S., Gudemann C., et al. Separation des cellules tumorales
urologiques grace a l'utilisation d'un cell saver combine a un. filter a
membrane.// J. Urol. (Paris). 1994. T.100 p.29-32.
72. Wiesel M., Gudemann C., Staehler G. Tumorzellseparation durch Cell Saver
und Membranfilterpassage.// Infusionstherapie. 1991. Bd.18 S.143-144.
73.Woda R., Tetzlaff J.E. Upper airway oedema following autologous blood
transfusion from a wound
drainage system.// Can. J. Anaesth. 1992. V.39 p.290-292.
74.Zauder H.L., Stehling L. DIC after intraoperative autotransfusion.// Anesth.
Analg. 1993. V.76
p.1175-1177.
75.Operating instructions C.A.T.S(r), 4th edition dated October 1997.
